Наиболее тяжелой коагулопатией у детей является гемофилия А с X-сцепленным рецессивным типом наследования, которой болеют в основном лица мужского пола. В мире распространенность этого заболевания составляет 1 случай на 5 000–10 000 новорожденных мальчиков. На сегодняшний день в РНПЦ детской онкологии, гематологии и иммунологии наблюдаются 120 детей с гемофилией А, из них 83 с тяжелой формой. Для диагностики наследственной патологии системы свертывания крови активно применяются молекулярно-генетические методы.
Причины и молекулярная характеристика
 Анжелика СолнцеваПричиной развития гемофилии А являются различные нарушения в гене F8, приводящие к дефициту фактора свертывания крови VIII (FVIII). Приблизительно в 30 % случаев эта патология возникает в результате спонтанных или de novo генетических нарушений, вследствие чего семейная история болезни отсутствует.
Анжелика СолнцеваПричиной развития гемофилии А являются различные нарушения в гене F8, приводящие к дефициту фактора свертывания крови VIII (FVIII). Приблизительно в 30 % случаев эта патология возникает в результате спонтанных или de novo генетических нарушений, вследствие чего семейная история болезни отсутствует.
У пациентов с наследственной формой гемофилии А, как правило, матери являются гетерозиготными носителями одного мутантного аллеля гена F8 и у них также могут определяться пониженные уровни активности фактора свертывания крови VIII, приводящие к незначительным клиническим проявлениям гемофилии А.
Сегодня известно более 3 000 патогенных аллельных вариантов в гене F8, связанных с фенотипом гемофилии А. В зависимости от локализации они влияют на белок фактора свертывания крови VIII: могут препятствовать связыванию FVIII с различными лигандами каскада свертывания крови и приводить к снижению функции или полному отсутствию синтеза FVIII; изменять экспрессию, транспорт через клетку, активность и стабильность FVIII.
Гемофилия A является одним из немногих генетических заболеваний, при котором наблюдается корреляция между генотипом и фенотипом. Тип генетических дефектов тесно коррелирует с остаточной активностью фактора свертывания крови VIII, склонностью к кровотечениям и тяжестью симптомов у пациентов с гемофилией А.
Все типы генетических нарушений в гене F8 могут приводить к развитию тяжелой формы заболевания. Однако при гемофилии А существует одна наиболее клинически значимая генетическая перестройка — инверсия 22 интрона гена F8, ответственная примерно за 50 % всех случаев тяжелой формы гемофилии A (см. рис. 1).
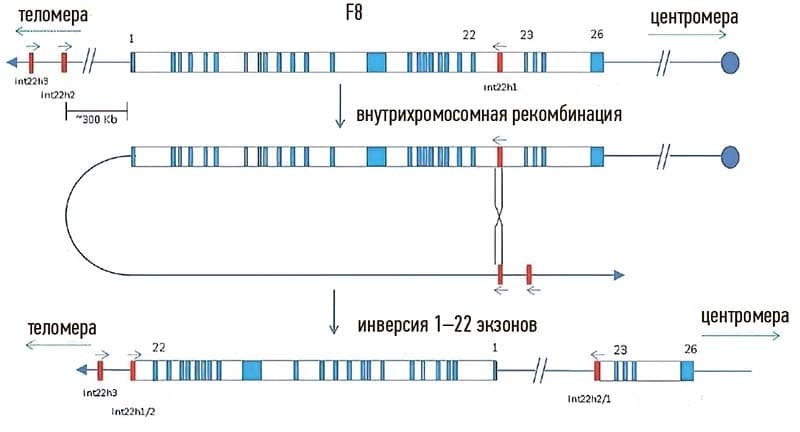
Рисунок 1. Механизм инверсии 22 интрона гена F8.
Также встречается инверсия 1 интрона гена F8, выявляемая у 2–5 % пациентов с тяжелой гемофилией А.
Все генетические варианты в гене F8 можно разделить на 2 основные группы: нулевые, приводящие к значительному нарушению или отсутствию белка FVIII (инверсия 22/1 интронов, крупные делеции, нонсенс-варианты, небольшие делеции/инсерции вне Poly-А регионов гена и варианты в регионах сайтов сплайсинга гена F8). И ненулевые варианты, которые представлены миссенс-вариантами и сопровождаются умеренным или легким фенотипом.
Факторы, участвующие в развитии осложнений заместительной терапии
 Ирина ГурьяноваОсновным методом лечения гемофилии А является заместительная терапия концентратами соответствующего фактора свертывания крови. Развитие антител к фактору свертывания крови VIII, называемых ингибиторами, является серьезным осложнением при заместительной терапии гемофилии А. Их появление приводит к частичному или полному инактивированию вводимого фактора свертывания крови VIII. Это сопровождается снижением коагуляционного ответа на введение лекарственных средств и невозможностью остановки кровотечения.
Ирина ГурьяноваОсновным методом лечения гемофилии А является заместительная терапия концентратами соответствующего фактора свертывания крови. Развитие антител к фактору свертывания крови VIII, называемых ингибиторами, является серьезным осложнением при заместительной терапии гемофилии А. Их появление приводит к частичному или полному инактивированию вводимого фактора свертывания крови VIII. Это сопровождается снижением коагуляционного ответа на введение лекарственных средств и невозможностью остановки кровотечения.
Образование ингибиторов имеет мультифакторную природу, включающую в том числе и генетический компонент. Основным признанным генетическим фактором риска развития ингибиторов является тип нарушения в гене F8: нулевые варианты ассоциируют с высоким риском, а ненулевые варианты — с низким риском.
Методы исследования
Большинство нарушений свертываемости крови в рутинной клинической практике диагностируют по количественному содержанию факторов свертывания крови. Появление технологий секвенирования, позволяющих выявить изменения в последовательности ДНК, помогло преодолеть ограничения стандартных методов исследования. Внедрение методов прямого секвенирования по Сэнгеру и высокопроизводительного секвенирования нового поколения (англ. next generation sequencing, NGS) повысило чувствительность методов скрининга и в настоящее время является золотым стандартом молекулярно-генетического анализа во всем мире.
 Александр ЛюбушкинПри гемофилии А молекулярно-генетическая диагностика остается единственным способом установить точный диагноз, преодолевая вариабельность данных, получаемых методами, основанными на количественном определении VIII фактора свертывания крови. Определение типа генетического дефекта у пациентов с гемофилией А важно для понимания особенностей течения заболевания и для индивидуализации тактики проводимого лечения в группе детей с высоким риском развития ингибиторов. Генетическая диагностика необходима и для дифференциального диагноза гемофилии А с другими схожими по клинико-лабораторным проявлениям наследственными коагулопатиями (легкой формы гемофилии А и болезни Виллебранда подтипа 2N).
Александр ЛюбушкинПри гемофилии А молекулярно-генетическая диагностика остается единственным способом установить точный диагноз, преодолевая вариабельность данных, получаемых методами, основанными на количественном определении VIII фактора свертывания крови. Определение типа генетического дефекта у пациентов с гемофилией А важно для понимания особенностей течения заболевания и для индивидуализации тактики проводимого лечения в группе детей с высоким риском развития ингибиторов. Генетическая диагностика необходима и для дифференциального диагноза гемофилии А с другими схожими по клинико-лабораторным проявлениям наследственными коагулопатиями (легкой формы гемофилии А и болезни Виллебранда подтипа 2N).
Недостатком метода секвенирования в диагностике гемофилии А является невозможность определения крупных генетических перестроек, таких как инверсии 22/1 интронов гена F8. Для диагностики этих нарушений используются методы на основе полимеразной цепной реакции (ПЦР), поскольку при подобных генетических перестройках не изменяется кодирующая последовательность гена F8, а изменяется ее пространственная ориентация относительно гена F8.
Таким образом, методы секвенирования не позволяют обнаружить генетическое нарушение в гене F8 примерно у 50 % пациентов с базовым уровнем активности FVIII ≤1 %.
Опыт применения генетического тестирования в РНПЦ ДОГИ
В центре разработан и успешно внедрен алгоритм генетической диагностики гемофилии A. Первоначально выполняется скрининг инверсии 22/1 интрона гена F8 у всех пациентов с базовой активностью FVIII ≤1 % методом ПЦР, а при отсутствии данной инверсии — проведение высокопроизводительного секвенирования кодирующих регионов гена F8. У пациентов с базовой активностью FVIII более 1 % проводится высокопроизводительное секвенирование без предварительного скрининга инверсии 22/1 интрона гена F8, поскольку такие генетические перестройки, в силу своей крайней патогенности, приводят к полному отсутствию коагуляционной активности FVIII (см. рис. 2).
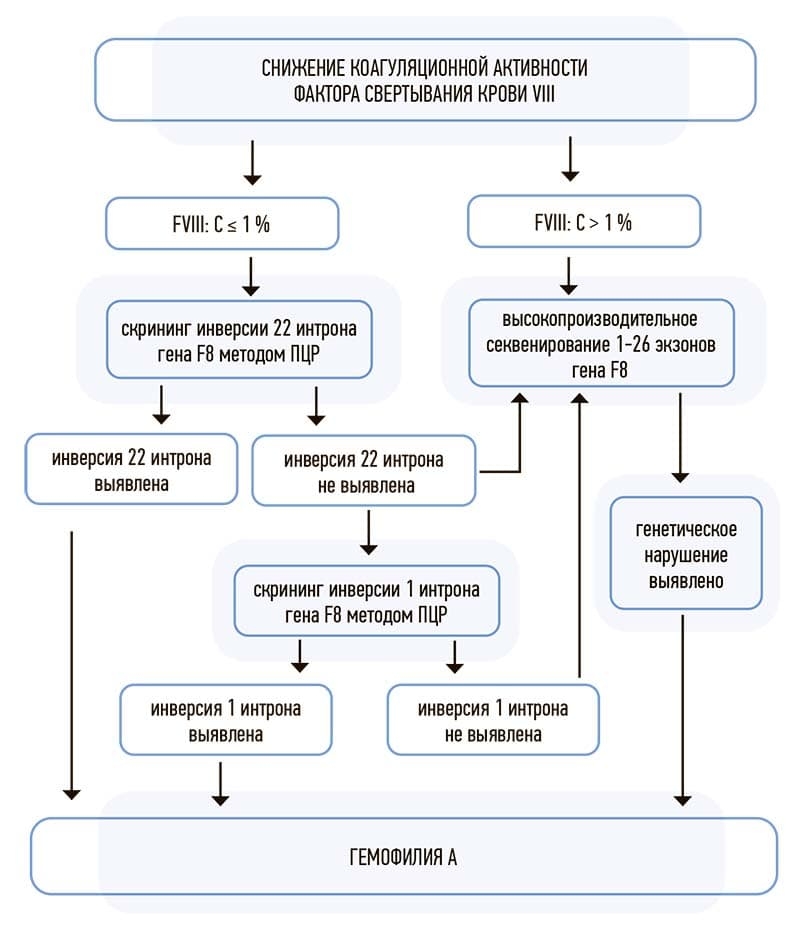
Рисунок 2. Алгоритм генетического исследования гемофилии А.
С 2020 года в РНПЦ ДОГИ генетическая диагностика с применением данного алгоритма успешно проведена более 100 пациентам со снижением коагуляционной активности FVIII. Это позволило верифицировать клинический диагноз, в т. ч. у 18 пациентов с легкими фенотипами гемофилии А; у 3 девочек на генетическом уровне доказать носительство патогенного аллеля гена F8.
Помимо этого генетическое тестирование предоставило возможность стратифицировать пациентов с гемофилией А на группы высокого и низкого риска по развитию ингибиторов к FVIII. Молекулярно-генетическое исследование, проведенное в РНПЦ ДОГИ, установило повышенный риск развития ингибиторов к вводимому FVIII у 61 из 83 пациентов с тяжелой формой гемофилии А. Это дало возможность персонифицировать подход к медицинской профилактике развития ингибиторной формы гемофилии А у ранее не леченных пациентов.
Таким образом, внедрение в рутинную клиническую практику молекулярно-генетических методов повышает точность диагностики, предоставляет возможность прогнозировать тяжесть клинических проявлений гемофилии А, точно и эффективно проводить диагностику носительства и генетическое консультирование пациентов и их семей.
