На долю острого лейкоза приходится 25–30 % всех злокачественных опухолей у детей и 75 % среди всех гемобластозов. Более 90 % острых лейкозов — это острый лимфобластный лейкоз (ОЛЛ), поэтому его условно называют «детским вариантом». Об особенностях инфекционных осложнений у иммунокомпрометированных пациентов рассказала Светлана Ходулева, заведующая курсом гематологии кафедры внутренних болезней № 1 с курсами эндокринологии и гематологии ГомГМУ, кандидат мед. наук, доцент.
Причины и факторы риска
 Светлана ХодулеваУровень заболеваемости ОЛЛ относительно высок в Китае, Японии, США, Европе, ниже — в Африке и Средней Азии; в целом 3–5 случаев на 100 тысяч детского населения в год. В Республике Беларусь — 4,2 случая на 100 тысяч.
Светлана ХодулеваУровень заболеваемости ОЛЛ относительно высок в Китае, Японии, США, Европе, ниже — в Африке и Средней Азии; в целом 3–5 случаев на 100 тысяч детского населения в год. В Республике Беларусь — 4,2 случая на 100 тысяч.
Факторы риска:
- мужской пол (чаще заболевают мальчики);
- возраст от 2 до 5 лет (66,4 %);
- высокий социально-экономический статус родителей;
- внутриутробная экспозиция к рентгеновскому облучению (диагностическому);
- лучевая терапия;
- синдром Дауна;
- нейрофиброматоз 1-го типа;
- синдром Блума;
- синдром Швахмана — Даймонда;
- синдром Ниймеген;
- атаксия-телеангиэктазия;
- большая масса тела при рождении;
- редко болеющие дети.
Существование множества факторов, находящихся в слабой ассоциации с риском развития ОЛ, свидетельствует в пользу модели ОЛЛ как результата сложного взаимодействия полиморфных генетических систем и элементов окружающей среды.
Современные возможности терапии позволили существенно изменить прогноз при остром лимфобластном лейкозе: пятилетняя бессобытийная выживаемость за 40 лет увеличилась с 5 % до 95 %. Ключевыми составляющими такого успеха в лечении явились использование 3–4-компонентной индукционной терапии (позволяет добиться полной ремиссии практически в 100 % случаев), профилактика поражений ЦНС, длительная поддерживающая терапия.
Причины неблагоприятных исходов прежде всего связаны с агрессивным течением опухолевого процесса или развитием рефрактерности (первичной, вторичной химиорезистентности опухоли), а также развившимися на фоне лечения осложнениями.
Частота инфекционных осложнений при цитостатической терапии ОЛЛ составляет 80 % и более.
Инфекции являются ведущей причиной летальности, не связанной с прогрессированием основного заболевания (68–75 %). Чаще всего они развиваются на этапе индукционной терапии — 77 %. Превалируют бактериальные инфекции (68 %), на долю грибковых приходится 20 %.
Основные факторы, определяющие развитие инфекций у детей с ОЛЛ (как и у других иммунокомпрометированных пациентов на фоне онкозаболеваний):
- миелосупрессия — угнетение нормального гемопоэза, обусловленное как самой опухолью, так и воздействием цитостатической терапии;
- нарушения клеточного и гуморального звеньев иммунитета;
- нарушение целостности физиологических барьеров (кожа, слизистая оболочка ЖКТ, т. к. именно условно-патогенная флора кожи и слизистой чаще всего является причиной инфекционных осложнений);
- наличие центрального венозного катетера;
- нарушения питания;
- изменения колонизационной микрофлоры организма пациента.
В последние годы тщательно изучается микробиом ЖКТ при остром лимфобластном лейкозе в поисках его влияния на развитие самого заболевания, тех или иных побочных эффектов на фоне полихимиотерапии. Как показывают результаты исследований, микробиом изменен уже при инициальной диагностике ОЛЛ, продолжает изменяться на этапах химиотерапии и остается измененным в период восстановления в течение 3 лет (что не исключает возможности негативных последствий для долгосрочного здоровья).
Нарушение микробиома влияет на побочные эффекты терапии. Преобладание Enterococcus является предиктором инфекции.
Инфекция в индукции — 76,2 %. Лидирующими патогенами являются:
- Escherichia coli — 52,9 %;
- Pseudomonas aeruginosa — 18,7 %;
- Klebsiella pneumoniae — 12,8 %;
- Enterobacter faecalis;
- Candida albicans.
Микробиологический пейзаж претерпевает изменения, что во многом определяется опухолью, курсами химиотерапии, стационаром, где находится пациент, состоянием нейтропении.
Особенности клинического течения инфекционных осложнений
Две трети инфекций при ОЛЛ возникают в периоды нейтропении и имеют следующие особенности клинического течения:
- стертость симптоматики;
- классические признаки воспалительного процесса не выражены;
- имеется вероятность быстрой генерализации процесса с развитием сепсиса и септического шока;
- выявить очаг инфекции удается не более чем у 30–50 % пациентов;
- выделение микроорганизмов из крови или других диагностически значимых биосубстратов — в 20–25 % случаев;
- в 50–70 % случаев единственным симптомом бывает повышение температуры.
При этом у пациентов с нейтропенией под лихорадкой понимают:
1) однократное повышение температуры тела более 38 °С;
2) два подъема температуры более 37,8 °С длительностью не менее одного часа;
3) два подъема температуры более 37,8 °С в течение 12 часов.
Диагностические мероприятия при лихорадке
Большинство пациентов с развившейся на фоне нейтропении инфекцией госпитализируются в онкогематологические стационары. Тем не менее решение о тактике ведения пациента, месте госпитализации зачастую принимает педиатр, т. к. именно он первым осматривает ребенка. Это серьезная ответственность.
В ряде случаев внезапного развития инфекционного процесса, при наличии жизнеугрожающих симптомов, если тяжесть состояния не позволяет транспортировать ребенка в специализированное медучреждение, то лечение проводится в стационаре по месту жительства.
Во время осмотра пациента важно помнить о стертости клинических проявлений инфекции. Наиболее частые очаги локализации инфекционного процесса — слизистая оболочка ротовой полости и перианальная область. Даже незначительные симптомы воспаления (умеренная гиперемия, болезненность) уже являются признаками инфекции.
На развитие септического шока указывают: жалобы на плохое самочувствие, выраженная сонливость, тахикардия, тахипноэ, замедление капиллярного заполнения, слабый пульс, олигоанурия.
Простые, но важные правила:
- измерение АД — обязательно (при этом помним, что гипотензия появляется только на поздних стадиях шока);
- не брать кровь из пальца;
- не проводить внутримышечных инъекций.
Дальнейшие лабораторно-инструментальные мониторинги этих пациентов зависят от возможностей стационара.
В стационарах по месту жительства:
1. ОАК.
2. Биохимический анализ крови.
3. Рентгенограмма легких.
4. УЗИ брюшной полости.
В специализированных стационарах:
1. Осмотр места стояния катетера, оценка длительности его нахождения и функционирования (проходимость в обе стороны и пр.).
2. Определение содержания С-реактивного белка и прокальцитонина, ИЛ-6, ИЛ-8.
3. Многократные бактериологические исследования.
4. Забор крови из катетера и периферической вены на определение культуры крови (аэробы, анаэробы, грибы).
5. Мазки из носоглотки, ануса, из поражений кожи.
6. Посев мочи на флору, копрокультура.
7. Определение антител к Herpes simplex и цитомегаловирусу (IgM). Выявление вирусов из различных мест повреждения, мочи, кала.
8. Рентгенография грудной клетки, компьютерная томография легких и КТ и/или МРТ-исследование органов брюшной полости, головного мозга и придаточных пазух для выявления очагов инфекции.
9. Диагностическая люмбальная пункция (при необходимости).
Фебрильная нейтропения требует быстрого назначения антибактериальной терапии. По всем рекомендациям лечение должно быть начато не позднее чем через 60 минут от начала лихорадки (диагностики фебрильной нейтропении).
Лечение
При неосложненной фебрильной нейтропении стартовая терапия может начинаться с бета-лактамных антибиотиков широкого спектра с псевдомонадной активностью.
При выборе эмпирической антибиотикотерапии нужно обращать внимание на следующие аспекты:
- относится ли пациент к группе высокого или низкого риска по развитию инфекционных осложнений;
- имеется ли аллергия на лекарственные препараты;
- есть ли дисфункция органов, особенно почек и печени;
- что включает в себя схема химиотерапии у пациента и когда было начато лечение (например, существуют данные об ассоциации между инфекциями, вызванными зеленящим стрептококком, и применением высоких доз цитарабина);
- получал ли пациент накануне антибиотики;
- особенности предшествовавшей колонизации резистентными бактериями, если возможно проводить микробиологический скрининг в медицинском учреждении.
В группу высокого риска развития тяжелых инфекций входят пациенты со следующими признаками:
1. Нейтропения (<100 клеток/мкл) с ожидаемой продолжительностью >7 дней.
2. Признаки печеночной недостаточности (повышение уровня АлАТ и/или АсАТ более чем в 5 раз выше верхней границы нормы) или почечной недостаточности (клиренс креатинина <30 мл/мин).
3. Сопутствующие патологические состояния, включающие, но не ограничивающиеся следующими составляющими:
- нестабильность гемодинамики;
- оральный или ЖКТ-мукозим, нарушающий глотание или вызывающий диарею;
- нарушения работы ЖКТ, в т. ч. боль в животе, тошнота, рвота или диарея;
- впервые появившиеся изменения неврологического или ментального статуса;
- признаки катетер-ассоциированной инфекции;
- появление нового инфильтрата в легких, гипоксемия или сопутствующие хронические заболевания легких;
- возраст пациента до 1 года.
К группе низкого риска развития тяжелых инфекций относятся пациенты:
- с предполагаемым разрешением нейтропении менее чем через 7 дней;
- стабильной и адекватной функцией печени и почек;
- отсутствием активных сопутствующих заболеваний.
Тщательно отобранные пациенты с низким уровнем риска развития инфекции могут быть кандидатами для пероральной эмпирической терапии. В группе высокого риска с ожидаемо большей длительностью нейтропении и другими признаками — исключительно стационарная терапия.
Рекомендуемые схемы стартовой антибактериальной терапии:
- пиперациллин+тазобактам+ аминогликозид (амикацин);
- тикарциллин+клавулановая кислота+аминогликозид (амикацин);
- цефтазидим/цефоперазон/цефепим+аминогликозид (амикацин);
- монотерапия карбапенемами: имипенем, меропенем;
- неосложненная «домашняя» инфекция:
- моксициллин+клавула-новая кислота 40–60 мг/кг в сутки в 3 приема,
- ципрофлоксацин 10–15 мг/кг в сутки в 2 приема.
В качестве примера представлен также алгоритм эмпирической антибактериальной терапии при развитии фебрильной нейтропении, разработанный в НМИЦ ДГОИ им. Дмитрия Рогачева (Москва) (см. рисунок).
Эффективность стартовой антибактериальной терапии следует оценивать через 24–36 часов, для того чтобы судить о ее достаточности, однако всегда необходим повторный с интервалами 8–12 часов детальный осмотр такого пациента с оценкой стабильности гемодинамики и степени интоксикации, появления новых инфекционных очагов.
Коррекция антибактериальной терапии проводится на основании клинических, визуализирующих и/или микробиологических данных. У пациентов с нейтропенией в случае эффективности антибактериальной терапии (отсутствие лихорадки и других признаков инфекции) она продолжается до разрешения нейтропении.
Критерии отмены антибиотиков:
1. Отсутствие лихорадки на протяжении минимум 48 часов.
2. Отсутствие признаков локализованной инфекции.
3. Стабильное клиническое состояние (нет дисфункции органов).
4. Длительность внутривенно АБ-терапии не менее 72 часов.
5. Абсолютное число нейтрофилов >500/мкл (>0,5ґ109/л).
Противогрибковые стратегии включают в себя профилактику, эмпирическую, упреждающую противогрибковую терапию и лечение установленной инвазивной грибковой инфекции.
Первичная противогрибковая профилактика инфекций, вызываемых дрожжевыми возбудителями, проводится пациентам, имеющим нейтропению и как минимум один из следующих факторов риска:
- мукозит;
- центральный венозный катетер, стоящий более 7 дней;
- нахождение в отделении реанимации и интенсивной терапии более 3 дней;
- полное парентеральное питание;
- АБ-терапия лекарственными препаратами широкого спектра действия;
- экстракорпоральная детоксикация;
- колонизация ЖКТ грибами рода Candida;
- прием системных ГКС (22 мг/кг/сут по преднизолону) 10 дней и более.
Профилактика проводится флюконазолом длительно на весь период нейтропении.
Важным при профилактике инфекционных осложнений при ОЛЛ является предупреждение развития пневмоцистной пневмонии.
Pneumocystis carinii/jirovecii — одна из причин тяжелого двухстороннего поражения легких у иммунокомпрометированных пациентов.
Пациенты с ОЛЛ входят в группу наиболее высокого риска по развитию пневмоцистной пневмонии: в отсутствие профилактики заболевание наблюдалось у 25–45 % детей с ОЛЛ. При этом треть случаев была, к сожалению, летальной.
Профилактику (триметоприм/сульфаметоксазол (ко-тримоксазол) 5 мг/кг по триметоприму 2 раза в день 3 дня в неделю) проводят с момента начала противоопухолевой терапии, продолжают в течение всего периода лечения и не менее одного месяца после окончания терапии.
Лечение: каспофунгин, TMP/SMZ (20 мг/кг в/в), глюкокортикостероиды.
Пациенты с ОЛЛ на фоне вторичного иммунодефицита подвержены развитию вирусных инфекций:
- Herpes simplex, Herpes zoster: лечение — ацикловир 30 мг/кг в день в 3 приема в/в капельно за 1 час в течение 5 (7) дней (минимально);
- ветряная оспа: быстро генерализируется в течение 24–72 часов. При отсутствии терапии поражение паренхиматозных органов с развитием гепатита, пульмонита и/или энцефалита наблюдается у 32–50 % пациентов, смертность может достигать 20 %.
Важно: для профилактики детям, не болевшим ветряной оспой и бывшим в контакте с потенциальным источником инфекции, необходимо введение специфического иммуноглобулина или внутривенного иммуноглобулина в течение 96 часов от момента контакта.
Если ни один из указанных препаратов не был введен или с момента контакта прошло более 96 часов, показано профилактическое назначение ацикловира в дозе 80 мг/кг/сут в 4 введения перорально в течение 7 дней (максимальная доза — 3 200 мг/сут).
Светлана Ходулева:
В ряде наблюдений показано, что дисбаланс в иммунной системе у детей с ОЛЛ сохраняется в течение 3 лет после окончания лечения. Это подчеркивает влияние современных схем химиотерапии на иммунитет и, следовательно, на восприимчивость к инфекциям, реакцию на иммунизацию.
Контроль инфекционных осложнений у детей с острым лимфобластным лейкозом должен проводиться как детским гематологом, так и педиатром первичного звена здравоохранения.
Только благодаря налаженному взаимодействию этих специалистов можно избежать развития жизнеугрожающих осложнений и улучшить результаты терапии.
Возрастающая роль педиатра обусловлена еще и тем фактом, что на современном этапе одним из принципов терапии ОЛЛ у детей является амбулаторный режим лечения. Педиатр часто становится первым специалистом, осматривающим заболевшего ребенка. Осведомленность об особенностях течения инфекций у иммунокомпрометированных пациентов, принципах их профилактики и терапии чрезвычайно важна.
Рисунок. Эмпирическая АБ-терапия фебрильной нейтропении
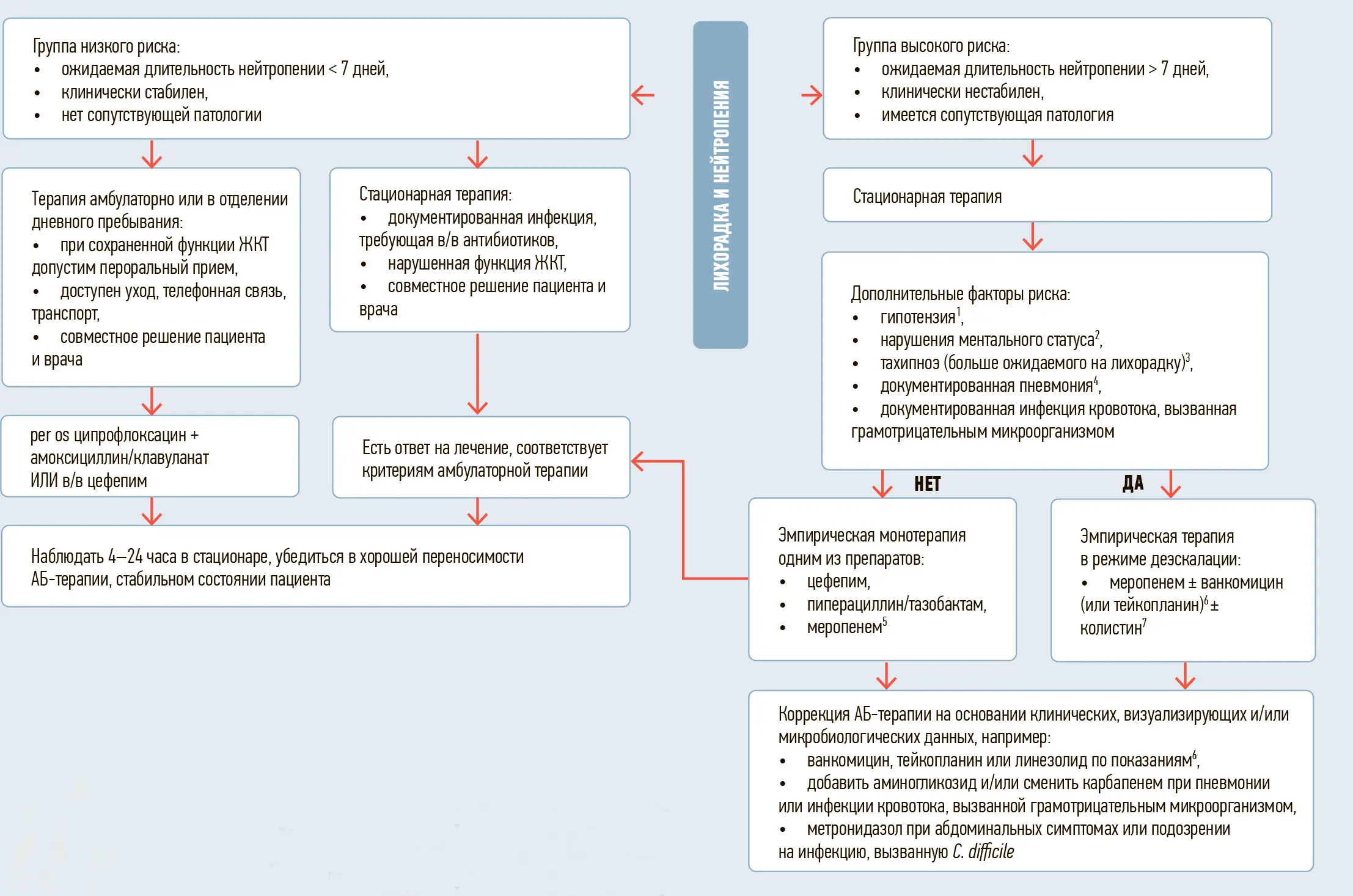
1 — определяется по САД (мм рт.ст.): 0-7 дней — < 59, 1 нед-1 мес — < 79, 1 мес-1 год — < 75, 1-5 лет — < 74, 5-12 лет — < 83, > 12 лет — < 90.
2 — определяется по шкале комы Глазго ≤ 14 баллов.
3 — определяется по ЧД: 0-7 дней — > 50, 1 нед-1 мес — > 40, 1 мес-1 год — > 34, 1-5 лет — > 22, 5-12 лет — > 18, > 12 лет — > 14. Ожидаемое увеличение ЧД на лихорадку: < 1 года — 7-11 дыханий в минуту на 1°С, 1-2 года — 5-7 дыханий в минуту на 1°С, старше 2 лет — 2-3 дыхания в минуту на 1°С.
4 — подтвержденная рентгенологическими исследованиями (рентгенография или КТ органов грудной клетки).
5 — показанием для проведения эмпирической монотерапии меропенемом у пациентов группы высокого риска без дополнительных факторов риска является документированная колонизация цефепим-резистентными, но карбапенем-чувствительными штаммами микроорганизмов семейства Enterobacteriaceae (K.pneumoniae, E.cloacae, E.coli), при выявлении карбапенем-резистентных штаммов индивидуальная терапия по данным антибиотикограммы.
6 — показаниями для эмпирической терапии препаратами, активными в отношении грамположительных микроорганизмов, являются: 1) гипотензия, 2) документированная пневмония, 3) подозрение на инфекцию области установки центрального венозного катетера, 4) инфекция кожи и мягких тканей, 5) документированная колонизация MRSA, 6) выделение грамположительного микроорганизма из гемокультуры, 7) выраженный мукозит (III-IV ст. по ВОЗ), 8) инфекции, вызванные пенициллин-резистентными стрептококками в анамнезе, 9) проведенная интенсивная химиотерапия, ассоциированная с высоким риском развития инфекции, вызванной грамположительными микроорганизмами (например, альфа-гемолитический стрептококк при применении высоких доз цитарабина).
7 — показаниями для эмпирической терапии колистином являются: документированная колонизация или инфекция в анамнезе (учитывается анамнез на протяжении последних 90 дней), вызванная мультирезистентными штаммами микроорганизмов, устойчивыми к альтернативным препаратам: карбапенем-резистентные P.aeruginosa, A.baumannii, бактерии семейства Enterobacteriaceae (K.pneumoniae, E.cloacae, E.coli), неблагоприятный эпидемиологический анамнез (нахождение в учреждениях/отделениях с высокой частотой инфекций, вызванных вышеуказанными микроорганизмами).
