Динамический мониторинг микробного пейзажа помогает улучшить результаты эмпирической АБ-терапии. Об этом на научно-практической конференции, прошедшей на базе МНПЦ хирургии, трансплантологии и гематологии, рассказала Ольга Руина, клинический фармаколог Нижегородского областного клинического онкологического диспансера (Россия), доцент кафедры общей и клинической фармакологии Приволжского исследовательского медицинского университета, кандидат мед. наук.
Неадекватная стартовая АБ-терапия повышает летальность
Ольга Руина:
Каждый врач решает тактическую задачу по лечению конкретного пациента, но клинический фармаколог и заведующий отделением всегда должны смотреть шире и решать стратегическую задачу по недопущению роста резистентных штаммов в отделении. Следует помнить о том, что любое использование антибиотиков влечет за собой рост резистентности, а неадекватная стартовая АБ-терапия повышает летальность в хирургических отделениях.
Как известно, антибиотикотерапия может быть этиотропной (с оценкой наиболее этиологически значимого микроорганизма, учетом антибиотикограммы и назначением препарата, точно бьющего в цель) и эмпирической (с вероятной оценкой потенциальных возбудителей и рисков АБ-резистентности).
Ольга Руина:
На практике, к сожалению, часто приходится использовать эмпирический подход. Наша больница, например, выполняет лабораторные исследования по аутсорсингу, что задерживает получение результатов. Но врач лимитирован фактором времени, особенно если пациент реанимационный в критическом состоянии, когда каждый час задержки АБ-терапии ухудшает прогноз. В некоторых случаях даже антибиотикограмма нам никак не помогает в выборе препарата, если, например, имеем мультирезистентность.
Микробный пейзаж хирургических отделений
Наибольшую значимость в микробном пейзаже хирургических стационаров имеют условно-патогенные возбудители группы ESKAPE: Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniaе, Acinetobacter baumannii, Pseudomonas aeruginosa, представители семейства Enterobacteriaceae. Особую опасность в плане тяжелых инфекционных осложнений представляют резистентные штаммы. Их разделяют на три группы. Мультирезистентные (MDR) — нечувствительность как минимум к трем и более классам АБ. Чрезвычайно резистентные (XDR) — нечувствительность почти ко всем классам АБ (кроме двух или одного класса). Панрезистентные (PDR) — нечувствительность ко всем классам АБ.
Ольга Руина рассказала, что при эмпирическом назначении антибиотика российские врачи используют онлайн-карту AMRmap (c информацией по резистентности микробных патогенов в стационарах по всей России). Также учитываются данные научных исследований «РеВАНШ» и «МАРАФОН», которые доказывают, что продуцентов бета-лактамаз расширенного спектра (БЛРС-продуцентов) в стационаре более 70 %, а порядка 23 % штаммов Klebsiella резистентны к карбапенемам.
Ольга Руина:
Клинические рекомендации также позволяют сориентироваться, хотя не всегда. Например, в лечении сепсиса предлагается на выбор очень большое количество антибиотиков, причем стоимость варьирует от 800 до 26 тысяч рублей (российских) в сутки. Возьмем более легкую нозологию, например, пневмонию, там выбор еще больше, стоимость от 800 до 36 тысяч рублей. И что конкретно должен назначить дежурный врач?
Клинический фармаколог вынужден считать и ограничен в выборе дорогостоящих препаратов. Если всем больным начнем назначать на старте эмпирическое лечение за 36 тысяч в сутки, то очень быстро у нас закончатся финансовые ресурсы. Разумеется, после получения результатов из лаборатории, когда подтверждается чувствительность возбудителя к конкретному препарату, он назначается. Но не на старте при эмпирическом подборе.
Такая ситуация сподвигла специалистов провести мониторинг микробного пейзажа каждого отделения и стационара в целом. Ольга Руина представила динамику данных за 6 месяцев, включающих более 500 исследований порядка 300 пациентов. Исследовались раны, дренажное отделяемое, кровь, перитонеальная жидкость и др.
Ольга Руина:
Активный «поставщик» бактериологических исследований — хирургические и реанимационные отделения, в меньшей степени — отделения химиотерапии (всего у нас три стационара с различными профилями). Наши результаты не отличаются от общероссийских: превалирует грамотрицательная флора — 70 %, на грамположительную приходится 21 %, на грибковую — 7 %. Высеваются клебсиелла, кишечная и синегнойная палочка, энтерококки, далее все остальные возбудители группы ESKAPE. Вот такая «средняя температура» по стационару.
Однако если смотреть более детально, то, по словам специалиста, частота выделения патогенов имеет отличия в зависимости от структурных подразделений. Так, в стационаре, где выполняют урологические и гинекологические операции, превалирует кишечная палочка. В стационаре, где проводятся самые тяжелые вмешательства на брюшной полости, с большим отрывом лидируют Klebsiella pneumoniaе, Acinetobacter baumannii, также здесь гораздо чаще высеваются грибы, в т. ч. редкие виды грибов (см. рисунок).
Рисунок. Сравнительный процент резистентных к АБ штаммов в абдоминальных отделениях гепатологии и колопроктологии.
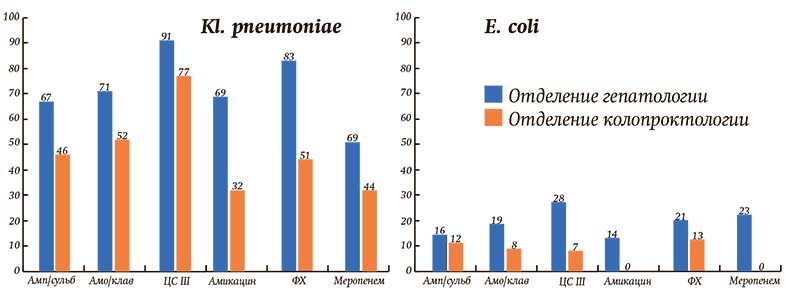
По профилю резистентности самые проблемные — клебсиелла (13 профилей резистентности, 81 % штаммов XDR, 55 % PDR), ацинетобактер (9 профилей резистентности, 92 % штаммов XDR, 49 % PDR), синегнойная палочка (14 профилей резистентности, 52 % штаммов XDR, 21 % PDR). Относительно «доброй» является кишечная палочка — 8 профилей резистентности, 23 % штаммов XDR, 0 % PDR (то есть не выявлено ни одного штамма, который был бы нечувствителен ко всем классам АБ).
Еще одна обнаруженная закономерность: высеваемые патогенные штаммы даже одного и того же возбудителя значительно отличаются по своей резистентности в зависимости от профиля отделения. В абдоминальном отделении, где сконцентрированы пациенты после гепатобилиарных вмешательств, — самая агрессивная флора, сопоставимая с реанимационным отделением, в отделении колопроктологии — более благоприятная флора (см. таблицу).
Таблица. Микробиологический мониторинг в хирургических абдоминальных отделениях.
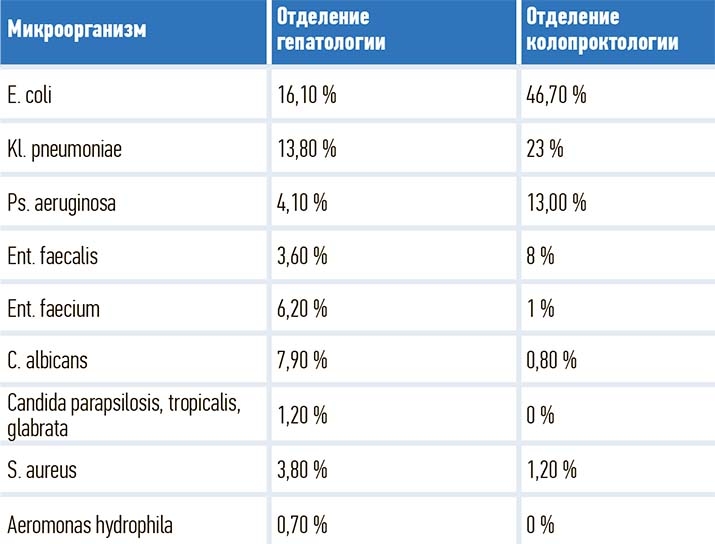
Ольга Руина:
Выполняя такую раскладку по отделениям, мы можем разрабатывать собственные локальные протоколы АБ-терапии, адаптированные непосредственно под каждое подразделение. Так, понятно, что в нашем отделении гепатологии нецелесообразно использовать цефалоспорины, пенициллины, фторхинолоны, и даже эффективность карбапенемов будет вариабельной. В то же время в отделении колопроктологии эти классы препаратов сохраняют актуальность, здесь можно даже воздержаться от назначения карбапенемов на старте, потому что эффективность цефалоспоринов будет достаточной.
Клинический случай
Специалист привела случай из практики, который наглядно иллюстрирует практическую пользу мониторинга микробного пейзажа в отделениях.
Пациентка Н., 42 года, рак большого дуоденального сосочка, в 2021 году выполнена резекция опухоли (по результатам гистологии — аденокарцинома), холецистэктомия, лимфаденэктомия. В 2023-м — рецидив аденокарциномы, осложненный панкреонекрозом. Повторное вмешательство, тампонирование, дренирование брюшной полости. Назначалась АБ-терапия: тигециклин+амикацин, достигнута положительная динамика, однако затем — вновь лихорадка без выраженных воспалительных изменений крови.
Эмпирически, с учетом факторов риска инвазивного кандидоза, начали терапию микафунгином. После получили результаты посевов отделяемого ротоглотки, мочи, брюшной полости — грибы Candida glabrata. На фоне противогрибковой терапии достигли положительной динамики. Пациентка готовилась к выписке. Однако вновь произошел скачок температуры. Возникли симптомы интоксикации, слабость, резко снизилось АД — 85/60 мм рт. ст. (проявления начала сепсиса).
С учетом микробного пейзажа в отделении начали эмпирическую АБ-терапию: цефоперазон/сульбактам+полимиксин В. Артериальное давление купировалось в течение суток, лихорадка — на следующий день.
В дальнейшем получен результат исследования дренажного отделяемого — Acinetobacter baumannii, штамм XDR, чувствительный к колистиметату, цефоперазону/сульбактаму. Терапия продолжалась 8 суток, после чего пациентка благополучно выписана домой.
Ольга Руина:
Таким образом, микробиологический мониторинг необходим для создания локальных протоколов АБ-терапии в конкретном учреждении. Это позволяет улучшить результаты эмпирического лечения, что особенно актуально в экстренных ситуациях.
Мониторинг по отделениям должен проводиться на постоянной основе, локальные протоколы периодически пересматриваться. И если в какой-то промежуток времени данные локального мониторинга в отделении отличаются от данных по стационару в целом, то в спорных ситуациях предпочтение следует отдавать локальным данным и, учитывая их, назначать эмпирическое лечение.
