Сегодня микробиом рассматривается как самостоятельный орган, который влияет на многие функции организма. Это во многом еще авангардное направление научных исследований интенсивно и на высоком уровне развивается в разных странах мира. Беларусь не исключение — в республике стремительно и успешно формируется отечественная научная школа микробиома. О научных интересах и результатах, которые могут представить наши ученые, «Медвестнику» рассказала Екатерина Малаева, заведующая кафедрой внутренних болезней № 1 с курсами эндокринологии и гематологии ГомГМУ, кандидат мед. наук, доцент.
Направление на пике актуальности
В последние два десятилетия микробное сообщество организма — микробиота — признано фундаментальным фактором, определяющим физиологию и патологию человека. Микробиом является вариабельной системой — не только адаптируется к сигналам и информации, поступающим от своего хозяина, но и в свою очередь влияет на него.
В области науки о микробиоте существует много терминов (микробиом, микрофлора, дисбактериоз), которые лечащему врачу чаще всего сложно разграничить и оценить. Что важно понимать? Микробиом — совокупность генов, микробных клеток и молекул межклеточного взаимодействия микроорганизмов, то есть понятие это очень широкое. Микробиота — совокупность непосредственно микроорганизмов в определенном локусе тела человека.
Значение кишечной микробиоты в развитии патологических состояний многих органов и систем стало очевидным после открытия осей взаимосвязи «микробиота кишечника — головной мозг», «микробиота кишечника — печень», «микробиота кишечника — дыхательная система», «микробиота кишечника — урогенитальный тракт» и других, что сделало кишечник едва ли не основным органом, отвечающим за здоровье человека.
Ассоциации спектра и характеристик микробиома доказаны в ряде инфекционных и неинфекционных заболеваний, а современные представления вышли далеко за пределы классического понимания роли микроорганизмов в нормальной и патологической физиологии человека. Исследования микробиома теперь актуальны во многих областях науки, которые ранее считались не связанными с микроорганизмами, таких как изучение циркадного ритма, нейрофизиология, онкология, трансплантология, судебно-медицинская экспертиза, спортивная медицина.
В связи с появлением новых знаний следует отметить, что от терминов «дисбактериоз» и «дисбиоз» необходимо отказываться, так как эти заключения основаны на культуральных методах исследования, а оценивать микробиом по данному методу — все равно что оценивать цвет глаз человека… по следу от его ботинка.
Не стоит забывать, что исследование микробиома является мультидисциплинарным направлением, и только командная работа ученых, клиницистов, IT-специалистов, владеющих понятиями современной биологии и различными языками программирования, является основой движения вперед.
Формирование отечественной научной школы микробиома и спектр интересов белорусских ученых
Изучение взаимодействия мира микробов и мира людей наряду с российскими и зарубежными исследователями активно проводится и белорусскими учеными.
Первая русскоязычная монография по микробиому человека (2018) и первое руководство для врачей (2020) на русском языке были подготовлены именно белорусскими авторами (профессорами Игорем Карповым и Игорем Стомой).
В 2020 году Беларусь посетил и выступил с открытой лекцией в НАН Беларуси ведущий мировой ученый в области микробиома, директор Института изучения микробиома Чикагского университета, лауреат премии Национального института здравоохранения США профессор Эрик Памер.
В 2021 году в Институте генетики и цитологии Национальной академии наук Беларуси при поддержке заместителя председателя Президиума НАН академика Александра Кильчевского открылся Республиканский центр изучения микробиома.
Большое количество исследований микробиома проводится белорусскими учеными в рамках финансируемых государственных программ научных исследований, таких как «Изучить особенности микробиоты различных биотопов организма человека в норме и при патологических состояниях, оценить ее значение в развитии заболеваний», «Разработать и внедрить метод медицинской профилактики инфекционных осложнений у пациентов после пересадки стволовых клеток и трансплантации солидных органов», «Разработать и внедрить метод определения вероятности развития пневмонии у недоношенных новорожденных», «Разработать и внедрить метод медицинской профилактики внутриутробной инфекции плода у беременных с урогенитальной инфекцией» и других, что в совокупности способствует расширению познаний в области микробиома и развитию персонализированной медицины.
Наряду с изучением микробиома в онкогематологии и установлением характеристик кишечного микробиома, которые ассоциируются с развитием грамотрицательных бактериальных инфекций кровотока у пациентов с опухолевыми заболеваниями кроветворной ткани после аллогенной трансплантации гемопоэтических стволовых клеток (ТГСК), инициированы и поддержаны новые направления исследования микробиома в трансплантологии, онкологии, гастроэнтерологии, пульмонологии, нефрологии, неврологии, гинекологии, неонатологии.
На базе МНПЦ хирургии, трансплантологии и гематологии проводятся исследования ранних посттрансплантационных осложнений при ТГСК на основе внедрения микробиом-ассоциированных предикторов.
ТГСК является методом выбора при лечении злокачественных и доброкачественных заболеваний, однако применение метода лимитировано развитием различных жизнеугрожающих осложнений, таких как фебрильная нейтропения, сепсис, инфекция кровотока.
Михаил Усс, Наталья Миланович, Татьяна Губанова, Игорь Искров, Анатолий Усс провели одноцентровое клиническое исследование, в результате которого внедрен рутинный мониторинг разнообразия микробиома кишечника на протяжении всего курса аллогенной ТГСК. Продемонстрирована возможность динамического наблюдения микробиома кишечника в реальных клинических условиях и доказано, что альфа-биоразнообразие микробиома значительно снижается при ТГСК по сравнению с исходным уровнем у отдельного пациента, что может быть связано с применением антибиотиков и режимом кондиционирования.
В выполненном исследовании, помимо снижения биоразнообразия, показана динамика соотношения основных таксономических типов в микробиоме на протяжении процедуры ТГСК и раннего посттрансплантационного периода, а именно снижение относительной плотности представителей типа Bacteroidetes c нарастанием представителей типа Proteobacteria.
В одном из клинических случаев в исследовании уровень типа Proteobacteria после ТГСК достиг доминирования, т. е. более 30 %, что, согласно ранее опубликованным данным, является предиктором инфекций кровотока. Изучено влияние таксономического состава микробиома кишечника на длительность течения фебрильной нейтропении. Показано, что большая представленность семейства Enterococcaceae и рода Enterococcus до трансплантации приводит к более высокому риску развития фебрильной нейтропении и сепсиса у пациентов после выполнения ТГСК.
Полученные данные позволяют внедрить мониторинг состава микробиома как механизм стратификации пациентов при выполнении ТГСК в отношении рисков инфекционных осложнений и других неблагоприятных исходов трансплантации.
Немаловажным является и то, что на практике отработана методология мониторинга и оценки показателей биоразнообразия микробиома на протяжении процедуры ТГСК, что в перспективе позволит определять группы риска по развитию инфекционных процессов, реакции «трансплантат против хозяина» и даже посттрансплантационной летальности.
Интересные исследования по изучению влияния кишечного микробиома на течение хронических прогрессирующих болезней печени и исходы трансплантации печени инициированы директором Минского НПЦ хирургии, трансплантологии и гематологии, академиком НАН Беларуси Олегом Руммо, ректором ГомГМУ Игорем Стомой и выполнены совместно коллективом ученых Умидом Салимовым, профессорами Алексеем Федоруком и Алексеем Щербой.
В работе было продемонстрировано, что микробиота кишечника имеет критически важную роль в процессах как естественной реконвалесценции после трансплантации печени, так и предикции развития таких тяжелых осложнений, как острое отторжение трансплантата и инфекционно-септические осложнения. При этом ключевую роль в развитии отторжения трансплантата могут играть Proteobacteria, Enterobacteriaceae и еще детально не изученные бактериальные штаммы, такие как Candidatus Saccharibacteria.
Данные, полученные в этом исследовании, позволили впервые в мире верифицировать несколько бактериальных таксонов, ответственных за развитие отторжения трансплантированной печени.
И это было подтверждено рецензентами The Journal of Liver Transplantation по результатам анализа литературы в базе данных Pubmed. А Умидом Салимовым успешно защищена докторская диссертация в Ташкенте.
Полученные результаты убедительно указывают на то, что влияние микробиоты кишечника на течение и прогрессию хронических болезней печени бесспорно. Однако глубина вовлеченности в патофизиологические процессы по-прежнему требует дальнейшего детального изучения.
Передовым направлением в неонатологии и педиатрии является изучение микробиома верхних дыхательных путей у недоношенных новорожденных, включая группу детей с экстремально низкой и низкой массой тела, которое проводится а РНПЦ «Мать и дитя» коллективом исследователей (Елена Улезко, Анастасия Старовойтова, Елена Зубовская и др.) при поддержке директора центра Сергея Васильева.
Целью проекта является внесение изменений в действующие клинические протоколы в разделе лечения врожденной пневмонии у новорожденных детей, а также создание метода определения вероятности развития врожденной пневмонии у недоношенных новорожденных.
Это позволит повысить выживаемость недоношенных младенцев различных сроков гестации, создать микробиом-ассоциированный метод прогноза вероятности развития врожденной пневмонии у недоношенных детей, повысить эффективность оказания медицинской помощи и снизить затраты на лечение недоношенных новорожденных с пневмонией.
Последние экспериментальные и клинические данные, посвященные роли микробиома кишечника в повышении артериального давления, позволяют развивать концепцию о том, что микробиота кишечника может быть новой терапевтической мишенью в профилактике и лечении заболевания для снижения сердечно-сосудистого риска.
В связи с этим в РНПЦ «Кардиология» при поддержке директора, профессора Натальи Митьковской совместно с РНПЦ эпидемиологии и микробиологии коллективом ученых (Ольга Павлова, Марина Черневская, Павел Семижон и др.) проводится исследование, посвященное изучению микробиоты кишечника у пациентов с артериальной гипертензией.
Исследования, которые ведутся в Гомельском госмедуниверситете
Изучение таксономического разнообразия микробиоты желудка у белорусской популяции и оценка его роли в развитии патологических состояний желудка, связанных с Helicobacter pylori, проводится на базе научно-исследовательской лаборатории ГомГМУ.
При анализе микробиоты желудка пациентов с диагнозом «гастрит» было идентифицировано 1 496 родов микроорганизмов, с диагнозом «хроническая язва желудка» — 1 592 рода микроорганизмов, с диагнозом «рак желудка» был определен 1 651 род бактерий.
Евгением Воропаевым установлены различия по композиционному составу микробиоты желудка у пациентов с инфекцией и без инфекции Helicobacter pylori. При сравнении микробиоты из неизмененных тканей желудка пациентов с диагнозами «гастрит» и «рак желудка» и диагнозами «рак желудка» и «язва желудка» выявлены достоверные различия. Данные исследования дают возможность оценить разнообразие микроорганизмов при заболеваниях желудка и, в свою очередь, могут способствовать разработке новых стратегий медицинской профилактики, диагностики и лечения хронической язвы желудка и рака желудка.
В многочисленных исследованиях, проведенных в разных странах мира, у пациентов с циррозом печени описаны специфические изменения фекальной микробиоты, которые преимущественно характеризуются уменьшением потенциально полезных таксонов, таких как Lachnospiraceae и Ruminococaceae, синтезирующих короткоцепочечные жирные кислоты и вторичные желчные кислоты из первичных, и увеличением патогенных Enterobacteriaceae, ассоциированных с выработкой эндотоксина (липополисахарида).
В работе Екатерины Малаевой показано, что при декомпенсации цирроза и неблагоприятном прогнозе заболевания микробиота кишечника и мочевыводящих путей претерпевает изменения и обогащается таксонами Proteobacteria, Armatimonadetes, Cyanobacteria, Fusobacteria, Tenericutes, которые потенциально усугубляют метаболические функции печени, почек, других органов, обладают гепатотоксичными эффектами, стимулируют фиброзообразование, участвуют в бактериальной транслокации и развитии системных воспалительных реакций.
Дальнейшее изучение микробиома будет способствовать пониманию патогенетических механизмов заболеваний печени и их осложнений и появлению новых перспективных методов профилактики и лечения.
В исследованиях была подтверждена двусторонняя связь кишечной микробиоты с ЦНС посредством вегетативной и энтеральной нервной систем, гипоталамо-гипофизарно-адреналовых взаимоотношений. Доказана способность микроорганизмов продуцировать гамма-аминомасляную кислоту, мелатонин, гистамин, ацетилхолин, которые играют роль системных и локальных нейротрансмиттеров. Бактериальные метаболиты (бутират, пропионовая кислота, ацетат) стимулируют клетки энтеральной и вегетативной нервной системы с последующим выбросом нейромедиаторов и влиянием на память и другие когнитивные функции.
Влияние микробиоты на развитие патологии нервной системы показано при следующих заболеваниях: болезнь Паркинсона и Альцгеймера, рассеянный склероз, боковой амиотрофический склероз, цереброваскулярные заболевания, артериовенозные мальформации, стресс, депрессия, мигрень, боли различной локализации, аутизм. Установлено, что у пациентов, перенесших инфаркт мозга или транзиторную ишемическую атаку, увеличено количество условно-патогенных микроорганизмов кишечного происхождения, таких как Enterobacter, Megasphaera, Oscillibacter и Desulfovibrio, а полезные роды, включая Bacteroides, Prevotella и Faecalibacterium, менее распространены. При этом системное воздействие Porphyromonas gingivalis связано с повышенным риском развития инфаркта мозга.
На базе Гомельской университетской клиники — областного госпиталя инвалидов ВОВ Натальей Усовой проведено проспективное исследование микробиома пациентов с постинсультным болевым синдромом. Выявлены различия в составе кишечной микробиоты у пациентов с различными подтипами постинсультного болевого синдрома (см. рис. 1).
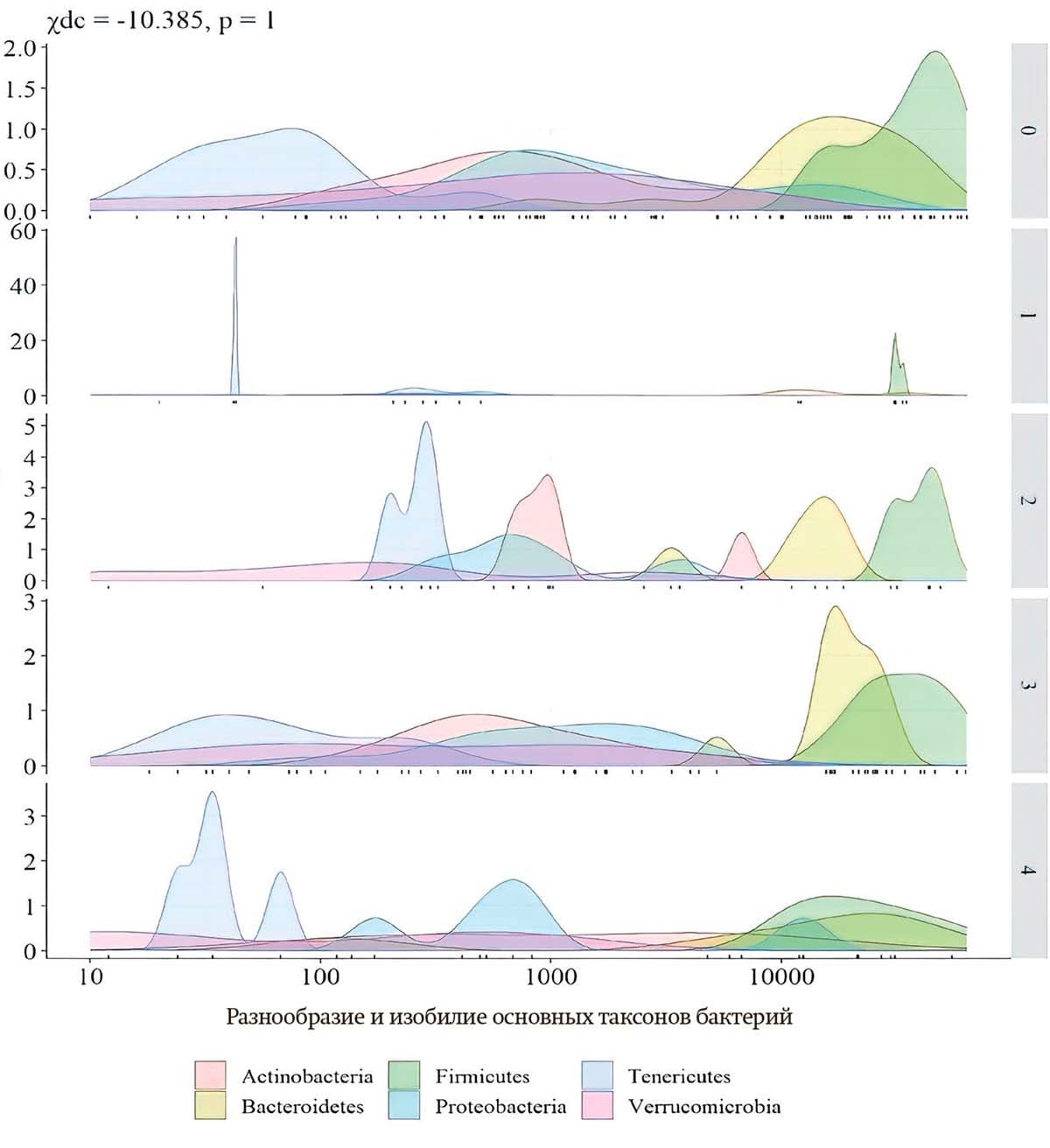
Рисунок 1. График плотности распределения основных таксонов бактерий в группах пациентов с разными подтипами постинсультного болевого синдрома
Примечание: 0 — группа сравнения без боли; 1 — скелетно-мышечная боль; 2 — боль в плече; 3 — центральная боль; 4 — головная боль.
Установлены различия у пациентов с различными фенотипами боли на уровне семейств. Так, у пациентов с фенотипом «головная боль» была снижена представленность микроорганизмов семейства Bacteroidaceae и Oscillospiraceae. Значимое отличие в количестве микроорганизмов семейств Bacteroidaceae выявлено у фенотипов центральной и головной боли. Разница в содержании микроорганизмов семейства Oscillospiraceae установлена у лиц с болью в плече и головной болью. Полученные результаты согласуются с данными других исследователей, показавших значимость микроорганизмов семейства Bacteroidaceae в патогенезе болевого синдрома при диабетической полиневропатии. Изучение особенностей микробиома при различных типах болевого синдрома позволяет уточнить новые механизмы патогенеза заболеваний и разрабатывать новые диагностические и лечебные методики.
Известно, что характеристики микробиома влагалища во многом определяют женское репродуктивное здоровье. Микробиоценоз влагалища динамически изменяется в зависимости от возраста, особенностей гигиены, питания и полового поведения, применяемых способов контрацепции, фазы менструального цикла. Особым состоянием является беременность, при котором стабильность влагалищной микрофлоры у матери определяет не только отсутствие заболевания, но и исход беременности.
По результатам работы Татьяны Захаренковой установлено, что при отсутствии у беременных в первом триместре урогенитальных инфекций в микробиоме влагалища, околоплодных вод и плаценты значимо выше представлены таксоны Proteobacteria по сравнению с беременными с урогенитальной инфекцией.
При урогенитальной инфекции у беременных наблюдается более высокая представленность таксонов, ассоциированных с бактериальным вагинозом, таких как Аtopobium vaginae, Mycoplasma hominis, Gardnerella vaginalis, Prevotella intermedia, при этом в околоплодных водах наблюдается большая представленность таксонов, относящихся к порядку Lactobacillales, а на уровне рода — Streptococcus, в плаценте же — таксонов, относящихся к типам Tenericutes и Bacteroidetes.
Перспективным является альнейшее изучение особенностей влагалищного и фетоплацентарного микробиома при различных осложнениях гестационного периода, а также исследование оси «кишечник беременной — фетоплацентарный комплекс».
Белорусскими учеными проводится также изучение микробиоты дыхательных путей, и в этом направлении получены интересные данные об ассоциации состава микробиоты респираторного тракта с ургентным течением инфекции COVID-19. Исследования проводятся Дмитрием Рузановым и Ириной Буйневич.
P.S. В нашей стране активно продолжаются и инициируются новые исследования микробиома человека как междисциплинарной проблемы. Перспективным направлением клинической медицины является прогнозирование изменений микробиома у спортсменов, людей с различными заболеваниями, после применения лекарственных средств, в том числе антибактериальных, и хирургических вмешательств. Разрабатываются принципиально новые и инновационные технологии создания фармакологически активных компонентов на основе микробиома здоровых людей, которые в дальнейшем могут быть использованы для поддержания и восстановления стабильности и функционирования экосистемы человека.