Неэффективность антибактериальных лекарственных средств представляется одной из самых серьезных проблем здравоохранения во всем мире. Наиболее часто микроорганизмы с множественной лекарственной устойчивостью вызывают инфекции, связанные с оказанием медицинской помощи. В последние годы увеличилось число пациентов, подверженных риску развития таких инфекций и сепсиса в связи с появлением новых режимов агрессивной иммуносупрессивной химиотерапии, ростом частоты и расширения контингента пациентов для проведения трансплантации гемопоэтических стволовых клеток.
В этом контексте изучаются и разрабатываются новые противоинфекционные стратегии, направленные на борьбу с бактериями, обладающими множественной лекарственной устойчивостью и экстремальной лекарственной устойчивостью.
Персонализация дозы и режимов дозирования
 Никита МательскийОдной из стратегий борьбы против штаммов микроорганизмов с множественной и экстремальной лекарственной устойчивостью является оптимизация и персонализация дозы и режимов дозирования антимикробных лекарственных средств для каждого пациента, с целью создания максимальной терапевтической эффективности при сведении к минимуму токсических эффектов, базируясь на особенностях фармакокинетики и фармакодинамики лекарственных средств.
Никита МательскийОдной из стратегий борьбы против штаммов микроорганизмов с множественной и экстремальной лекарственной устойчивостью является оптимизация и персонализация дозы и режимов дозирования антимикробных лекарственных средств для каждого пациента, с целью создания максимальной терапевтической эффективности при сведении к минимуму токсических эффектов, базируясь на особенностях фармакокинетики и фармакодинамики лекарственных средств.
Основными параметрами фармакокинетики являются клиренс (объем плазмы, очищающийся от препарата за единицу времени), объем распределения и период полувыведения (время, в течение которого концентрация лекарственного средства в плазме уменьшится вдвое).
Объем распределения (Vd) — это гипотетический объем жидкости, необходимый для равномерного распределения введенной дозы лекарственного средства в концентрации, равной его концентрации в сыворотке крови. Более высокое значение показателя Vd свидетельствует о том, что лекарственное средство интенсивно распределяется в тканях, а низкое значение Vd — о том, что оно концентрируется в плазме. На объем распределения влияют свойства лекарственного средства, такие как липофильность, гидрофильность, степень связывания с белками плазмы и молекулярная масса. Для липофильных антимикробных лекарственных средств, которые легко проникают через тканевые барьеры, характерны высокие значения Vd. Гидрофильные антимикробные лекарственные средства характеризуются более низкими значениями Vd.
Септические состояния могут оказывать выраженное влияние на фармакокинетику лекарственных средств. Например, объем распределения у пациентов с сепсисом значительно увеличивается для гидрофильных антимикробных лекарственных средств за счет повышенной проницаемости капилляров (синдром капиллярной утечки), поэтому требуются гораздо большие дозы для достижения оптимальной концентрации в очаге инфекции.
Дозирование антимикробных лекарственных средств для пациентов отделений реанимации и интенсивной терапии (ОРИТ) вызывает еще большие трудности, поскольку необходимо учитывать сопутствующую полиорганную недостаточность, проводимую массивную инфузионную терапию, сопутствующую гипопротеинемию и т. д.
Известно, что различные антимикробные лекарственные средства имеют разную степень связывания с белками плазмы крови. Так, например, меропенем и дорипенем связываются с белками плазмы крови на 5–10 %, в то время как ванкомицин — на 55–60 %, тейкопланин — на 95 %.
Снижение уровня сывороточного альбумина у пациентов в критическом состоянии приводит к снижению связывания антимикробного лекарственного средства с белками и повышению уровня свободной фракции для антимикробного лекарственного средства с высокой степенью связывания с белком. Это может увеличивать вероятность побочных эффектов.
Например, развитие почечной недостаточности при использовании ванкомицина или тейкопланина.
По данным проспективного обзорного исследования среди пациентов, находившихся в ОРИТ и получавших антимикробные лекарственные средства, увеличенный почечный клиренс (клиренс креатинина >130 мл/мин/1,73 м2), имел место у 51,6 % и приводил к более высоким показателям неэффективности лечения в сравнении с пациентами отделений общего профиля (27,3 % против 12,9 %, p=0,04). По результатам проведенного исследования DALI (Defining antibiotic levels in intensive care unit patients), которое включало около 500 пациентов из 70 ОРИТ, эксперты пришли к выводу, что дозирование антимикробных лекарственных средств у пациентов ОРИТ должно отличаться от стандартного режима дозирования.
Это обусловлено проведением инфузионной терапии, наличием полиорганной недостаточности, увеличением объема распределения, поэтому дозирование антимикробных лекарственных средств не может быть идентичным рекомендуемому для общесоматического профиля, так как фармакокинетика/фармакодинамика на начальном этапе исследуется среди здоровых добровольцев. Изучение концентрации у пациентов в ОРИТ демонстрирует, что для достижения эффекта дозу необходимо увеличивать на 74 % от рекомендуемой.
Для пациентов реанимационного профиля вероятность летального исхода у лиц с септическим шоком значительно увеличивается в случае, если антимикробная терапия назначается неадекватно либо более чем через 1 час, и возрастает на 8 % каждый час в течение первых 6 часов после установления диагноза.
На первый план выходит проведение терапевтического лекарственного мониторинга (ТЛМ), который представляет собой измерение содержания лекарственного средства в крови с целью оптимизации его дозировки, достижения максимальной эффективности и минимизации токсичности. ТЛМ особенно актуален для антибиотиков с узкими терапевтическими диапазонами и весьма вариабельной фармакокинетикой.
Особенности фармакокинетики антимикробных лекарственных средств
Специалисту, назначающему антибактериальную терапию, важно понимать, что все антимикробные лекарственные средства с позиции своей фармакокинетики делятся на три группы.
1. Время-зависимые. Эффективность этих препаратов зависит от времени, в течение которого плазменная концентрация антибиотика превышает минимальную подавляющую концентрацию (МПК) для конкретного возбудителя (fT > МПК). К этой группе относятся все бета-лактамные антибиотики (пенициллины, цефалоспорины, карбапенемы и монобактамы). Режим дозирования данных лекарственных средств, как правило, основан на делении всей суточной дозы на 3–4 введения с целью минимизации интервалов между введениями.
2. Концентрационно-зависимые. Эффективность определяется отношением максимальной плазменной концентрации к МПК (Cmax/МПК). К данной группе относятся аминогликозиды, полиены. Для них наиболее предпочтительно назначение всей суточной дозы на одно введение.
3. Промежуточная группа. Антимикробные лекарственные средства, которые можно отнести к время-зависимым и к концентрационно-зависимым лекарственным средствам. Их эффект определяется соотношением площади под фармакокинетической кривой (AUC) к МПК (AUC/МПК). К лекарственным препаратам из промежуточной группы относятся полимиксины, гликопептиды, оксазолидиноны, глицилциклины, фторхинолоны, нитроимидазолы, макролиды, эхинокандины, азолы.
Количественное определение и целевые диапазоны плазменной концентрации
Для количественного определения лекарственных средств, в том числе антибиотиков, в плазме или сыворотке крови существует множество методов. Золотым стандартом является метод высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием (ВЭЖХ-МС).
Впервые в Беларуси в РНПЦ детской онкологии, гематологии и иммунологии (под руководством директора, доктора мед. наук, профессора Анжелики Солнцевой, заведующего отделением анестезиологии и реанимации Дмитрия Солоненко) совместно с Национальной антидопинговой лабораторией (под руководством директора, доктора биол. наук, доцента Юрия Походни, ведущего химика отдела антидопинговых исследований Романа Пузанова) началось активное внедрение методики по терапевтическому лекарственному мониторингу антимикробных лекарственных средств у пациентов с сепсисом, находящихся в критическом состоянии.
Забор образцов крови у пациентов производится на третьи сутки от начала терапии антибиотиком. После чего пробы центрифугируются, разделяются на несколько образцов, замораживаются и передаются в антидопинговую лабораторию, где и проводится количественное определение антимикробных лекарственных средств. В работе используется жидкостной хроматограф с масс-спектрометрическим детектором.
Эффективное дозирование бета-лактамных антибиотиков определяется тем, что для пациентов в критическом состоянии целевой диапазон плазменной концентрации должен укладываться в интервал от 4-кратного значения МПК до 10-кратного значения МПК на протяжении 100 % режима дозирования (fT100% — 4–10×МПК). Значения минимальной подавляющей концентрации, которые необходимо использовать, указаны в руководстве Европейского комитета по тестированию на чувствительность к противомикробным препаратам (European Committee on Antimicrobial Susceptibility Testing, EUCAST), например, для меропенема это 8 мг/л.
Дозирование бета-лактамных антибиотиков на примере меропенема
Клинический случай. Пациент мужского пола, возраст 16 лет. Диагноз: синдром Вискотта — Олдрича (первичный иммунодефицит), состояние после аллогенной ТГСК, хроническая РТПХ, распространенная форма. У пациента регистрируется ИСМП, вызванная P.aeruginosa (МПК меропенема — 8 мг/л). Инициально пациент получает стандартный интермиттирующий режим дозирования меропенема по 2 000 мг 3 р/сут в виде 3-часовой инфузии. Контрольные точки отбора крови для определения сывороточной концентрации меропенема следующие: 0; 1,5; 3; 4; 8 часов (см. рис. 1).
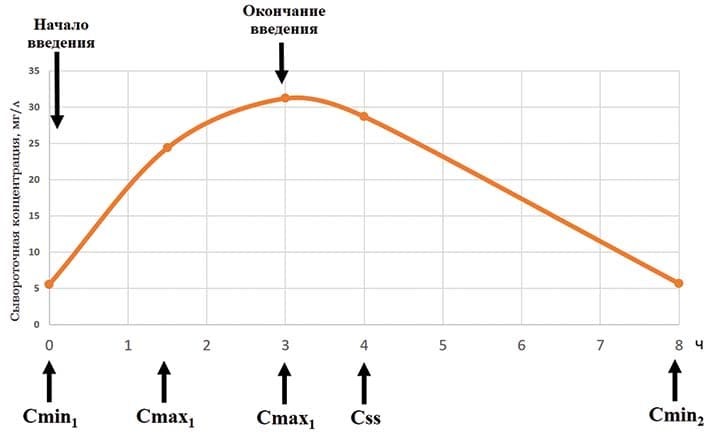
Рисунок 1.Контрольные точки отбора образцов крови.
Далее проводилось изменение режима дозирования: переход от интермиттирующего к непрерывному суточному титрованию. Предварительно вводилась нагрузочная доза в количестве 2 000 мг за 1 час, далее 6 000 мг меропенема вводились в виде непрерывной суточной инфузии. Отбор образцов крови с целью определения плазменной концентрации меропенема проводился на третьи сутки.
Расчеты фармакокинетических параметров произведены для однокамерной модели с помощью программного обеспечения Microsoft Excel 2010. Дополнительно в день проведения фармакокинетического исследования определяли клиренс эндогенного креатинина методом Cockcroft-Gault.
Полученные результаты плазменной концентрации меропенема во время интермиттирующего и непрерывного суточного титрования приведены в таблице и на рисунке 2. Как видно, в случае интермиттирующего режима дозирования наблюдаются интервалы с субтерапевтическими плазменными концентрациями, которые составляют порядка 25 % режима дозирования. Поэтому предпочтительным режимом дозирования для меропенема является непрерывное суточное титрование с предварительной нагрузочной дозой.
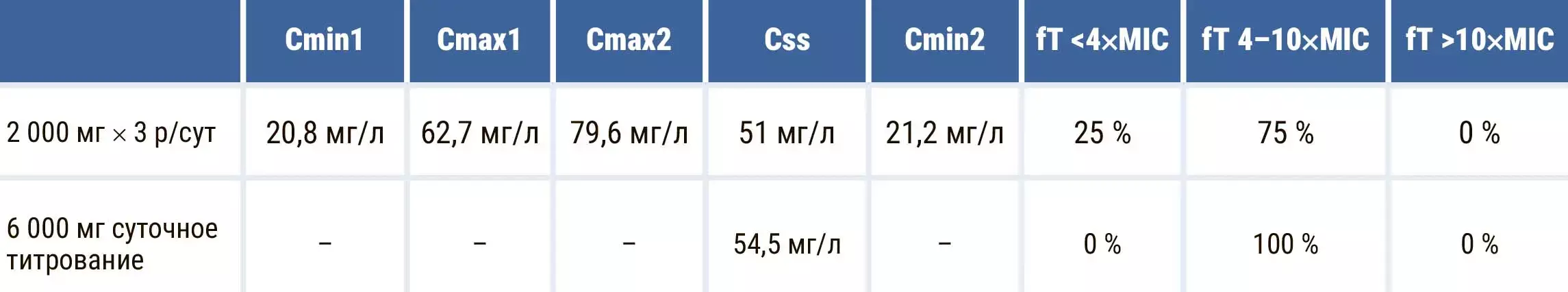
Таблица. Плазменные концентрации меропенема в зависимости от различных режимов дозирования.
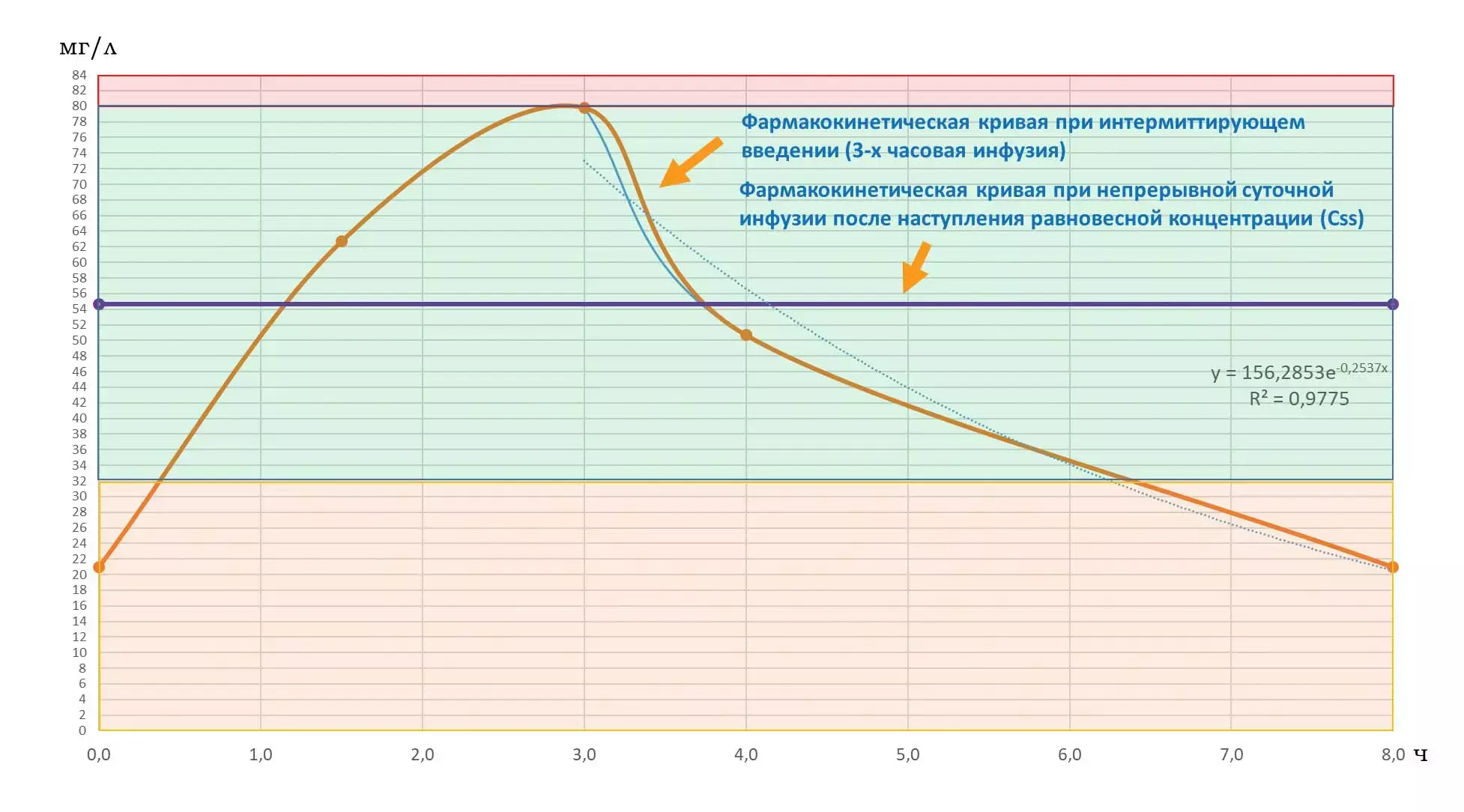 Рисунок 2.Фармакокинетические кривые различных режимов дозирования.
Рисунок 2.Фармакокинетические кривые различных режимов дозирования.
Заключение. Для пациентов отделения реанимации и интенсивной терапии, находящихся в критическом состоянии на фоне развития инфекций, связанных с оказанием медицинской помощи, при подборе эффективной и безопасной дозы антимикробных лекарственных средств необходимо в обязательном порядке осуществлять проведение терапевтического лекарственного мониторинга с дальнейшей своевременной коррекцией дозы лекарственного средства в зависимости от плазменной концентрации.
Из опыта отделения анестезиологии и реанимации РНПЦ ДОГИ наиболее приемлемым режимом дозирования для бета-лактамных антибиотиков, в частности для меропенема, является непрерывное суточное титрование с предварительной нагрузочной дозой.
