Боль — один из самых распространенных симптомов во всех сферах медицины. Боль может причинять пациенту сильные мучения, нарушает сон, не дает заниматься работой и повседневными делами, полноценно общаться с близкими людьми, снижает качество жизни и эффективность лечения основного заболевания. Длительно существующая хроническая боль влияет на качество и продолжительность жизни человека. В паллиативной практике вопросы адекватного обезболивания особенно актуальны.
 В настоящее время широкое распространение получил термин pain management (управление болью), лежащий в основе современного обезболивания. Новые подходы включает готовящийся к публикации клинический протокол «Фармакотерапия основных патологических симптомов (синдромов) при оказании паллиативной медицинской помощи пациентам (взрослое население) в стационарных, амбулаторных условиях и на дому», утвержденный постановлением Минздрава от 7 сентября 2022 г. № 96.
В настоящее время широкое распространение получил термин pain management (управление болью), лежащий в основе современного обезболивания. Новые подходы включает готовящийся к публикации клинический протокол «Фармакотерапия основных патологических симптомов (синдромов) при оказании паллиативной медицинской помощи пациентам (взрослое население) в стационарных, амбулаторных условиях и на дому», утвержденный постановлением Минздрава от 7 сентября 2022 г. № 96.
Причины возникновения
Выделяют три основные группы причин боли:
- травмы — раны, переломы, вывихи, ожоги, ушибы и пр.;
- заболевания — болевым синдромом сопровождаются хронические болезни внутренних органов и нервной системы, инфекции, злокачественные опухоли;
- хирургические вмешательства.
Боль объединяет в себе два противоречивых понятия. С одной стороны, как говорили врачи прошлого, «боль — сторожевой пес здоровья», с другой — длительно существующая, некупирующаяся хроническая боль вызывает ряд патологических эффектов: тягостное переживание, ограничение подвижности, нарушение микроциркуляции, снижение иммунной защиты, дизрегуляция функций органов и систем.
Болевая и противоболевая системы
Болевая система организма состоит из болевых рецепторов (ноцицепторов) — мультимодальных, реагирующих на термические, химические и другие раздражители, миелинизированных и немиелинизированных афферентных волокон, нейронов задних рогов спинного мозга, неоспиноталамического тракта и полисинаптических цепей в ретикулярной формации, таламусе, коре головного мозга.
Противоболевая система включает нисходящие пути опиатной, серотонинергической, норадренергической систем, систему ядер ретикулярной формации, гипоталамо-спинальную систему.
Анальгетики, используемые в клинической практике, влияют на компоненты болевой системы, адъюванты — на компоненты противоболевой системы.
Типы боли
В зависимости от механизмов возникновения выделяют несколько типов боли.
Ноцицептивная вызвана раздражением мультимодальных болевых рецепторов из-за деформации или повреждения тканей. При этом функция сенсорных нервных волокон (соматических или висцеральных) не нарушена. В зависимости от локализации активированного ноцицептора выделяют: ноцицептивную соматическую боль (кожа, мышцы, сухожилия, кости), которая чаще всего хорошо локализована, может быть преходящей или постоянной, вариабельной по характеру (тупая или острая, давящая, пульсирующая, дергающая, сверлящая, грызущая, распирающая, другая); ноцицептивную висцеральную боль (внутренние органы, оболочки органов), которая плохо локализована, имеет разлитой характер (тупая, приступообразная, сжимающая, схваткообразная, тянущая, изнуряющая, другая).
Нейропатическая боль является результатом повреждения соматосенсорной нервной системы. Патофизиологический механизм заключается в повышенной возбудимости нейронов и спонтанной активности в месте повреждения, каскаде нейрохимических и физиологических изменений в ЦНС, преимущественно в задних рогах спинного мозга (центральная сенситизация). Это приводит к спонтанному возникновению боли, гипералгезии (слабые болевые стимулы воспринимаются как более сильные) и аллодинии (неболевые стимулы вызывают боль) в областях, прилежащих к зоне повреждения. По характеру описывается как поверхностная жгучая боль, особенно при периферических поражениях; спонтанная стреляющая или колющая боль, «как удар электротоком», глубокая тупая боль.
Дисфункциональная (ноципластическая) боль возникает при отсутствии явных признаков поражения тканей или соматосенсорной нервной системы. Для пациентов с таким типом боли характерны повышенная утомляемость, раздражительность, нарушения сна и функций висцеральных органов, неадаптивные стратегии преодоления боли, которые обусловлены измененной реактивностью мозга в целом.
Смешанная боль — сочетание различных механизмов формирования хронической боли у одного пациента.
Кроме этого боль классифицируют по причине: онкологическая и неонкологическая; по длительности: острая (до 3 месяцев), хроническая (более 3 месяцев), прорывная; по интенсивности: слабая — 1–3 балла, умеренная — 4–6 баллов, сильная — 7–10 баллов, в соответствии с нумерологической оценочной шкалой.
Аспекты диагностики
В процессе диагностики типа боли необходимо:
- определить локализацию, иррадиацию, характер болевого синдрома, причины, вызывающие боль, длительность боли, что помогает ее купировать;
- уточнить число и локализацию очагов боли, длительность предшествующего болевого анамнеза, применяемые ранее и в настоящее время анальгетики, эффективность предшествующей терапии боли, влияние боли на физическую активность, продолжительность ночного сна, возможность приема пищи и другие компоненты, характеризующие качество жизни.
Принципы купирования хронической боли
В основе фармакотерапии хронической боли должен лежать персонифицированный подход. Существуют также другие общие принципы назначения анальгетиков, которые включают:
- регулярное назначение «по часам», а не «по требованию». Очередную дозу лекарственного препарата пациент должен получать до прекращения действия предыдущей дозы;
- применение «по восходящей» — от максимальной дозы слабо действующего лекарственного препарата к минимальной дозе сильнодействующего;
- нежелательные реакции анальгетиков должны предупреждаться, а в случаях их возникновения адекватно лечиться;
- основными способами введения лекарственных препаратов являются неинвазивные;
- при лечении хронического болевого синдрома любой интенсивности прежде, чем увеличивать дозу анальгетика, необходимо назначить адъюванты.
Принципы фармакотерапии хронической боли разработаны в соответствии с трехступенчатой лестницей обезболивания, рекомендованной ВОЗ.
Основная цель лечения боли — устойчивое обезболивание, при котором интенсивность персистирующей хронической боли в течение суток составляет 3 и менее баллов по нумерологической оценочной шкале или оценивается в ином эквиваленте переносимой боли и (или) полной анальгезии и не сопровождается нежелательными реакциями.
Нестероидные противовоспалительные средства
НПВС наиболее часто назначаются при слабой или умеренной боли, реже в комбинации с другими средствами при сильной боли. Новый клинический протокол включает достаточное количество НПВС, что позволяет сделать правильный выбор препарата с учетом характеристик боли и персональных особенностей пациента, наличия коморбидной патологии: диклофенак, этодолак, кеторолак, ацеклофенак, лорноксикам, мелоксикам, ибупрофен, кетопрофен, декскетопрофен, ибупрофен в комбинации с другими препаратами (ибупрофен + парацетамол, ибупрофен + питофенон + фенпивериний), целекоксиб, эторикоксиб, нимесулид.
По силе анальгетического действия в порядке убывания: лорноксикам, кетопрофен > кеторолак >диклофенак > индометацин >метамизол > пироксикам, теноксикам, мелоксикам > нимесулид >напроксен > ибупрофен > целекоксиб > аспирин > парацетамол.
Выбор НПВС в каждом конкретном случае определяется оценкой их эффективности, безопасности и избирательности влияния на ферменты системы циклооксигеназ.
Критерии эффективности: уменьшение боли, улучшение физических функций, качества жизни.
Критерии безопасности: выявление факторов риска желудочно-кишечных, сердечно-сосудистых, почечных, неврологических и других нежелательных лекарственных реакций, их мониторинг и при возможности коррекция.
Риски осложнений
Со стороны ЖКТ: умеренный риск (пожилой возраст, язвенный анамнез, прием ГКС, курение и прием алкоголя и др.); высокий риск (язвенный анамнез, прием препаратов, влияющих на свертываемость крови); очень высокий риск (осложненные язвы с кровотечениями и перфорациями, комбинация 2 и более различных факторов риска).
Со стороны сердечно-сосудистой системы: умеренный риск (компенсированные лечением АГ и ХСН, традиционные кардиоваскулярные риски при отсутствии ИБС); высокий (не компенсированные лечением АГ и ХСН, неосложненная ИБС); очень высокий (ИБС, перенесенный инфаркт миокарда, операции на сердце (АКШ, эндоваскулярное стентирование), ишемический инсульт).
Проблема обезболивания в период COVID-19
В период пандемии задача лечения боли с применением НПВС стала очень актуальной. В остром периоде инфекции у пациентов часто встречаются артралгии, миалгии. При постковидном синдроме — артриты, которые могут быть дебютным проявлением аутоиммунных заболеваний наряду с усталостью, кашлем, болями в груди, суставах, одышкой.
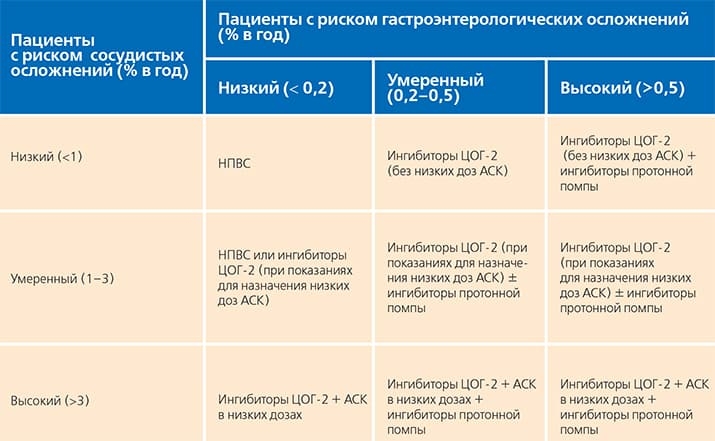
Европейское медицинское агентство (ЕМА), осуществляющее контроль за безопасностью лекарственных средств, опубликовало документ, в котором сообщается, что «в настоящее время нет научных доказательств, устанавливающих связь между НПВС и ухудшением течения заболевания COVID-19». Рекомендуется применение НПВС в минимальной эффективной дозе в течение наиболее короткого периода времени, с учетом преимуществ и рисков, отраженных в инструкциях к препаратам, которые должны учитываться наряду с национальными клиническими рекомендациями (см. таблицу).
Таблица. Тактика применения НПВС при наличии риска желудочно-кишечных и кардиоваскулярных нежелательных лекарственных реакций (C. Baigent et C. Patrono в модиф. Е. Л. Насонова, 2003).
Метаанализ эпидемиологических исследований, выполненных с января 1982-го по май 2011 года, оценил относительный риск развития желудочно-кишечных осложнений при использовании различных НПВС: целекоксиб продемонстрировал минимальный риск (ОШ 1,45, ДИ 1,17–1,81), аналогичный показатель был получен для ацеклофенака (ОШ 1,43, ДИ 0,65–3,15). Для всех других НПВС опасность осложнений для ЖКТ была отчетливо выше.
В целях профилактики НПВС-гастропатии рекомендуют выбор селективных ингибиторов ЦОГ-2 вместо «классических» НПВС, прием антагонистов Н-2 рецепторов внутрь 2 раза в сутки (низатидин 150 мг, ранитидин 150 мг, фамотидин 20 мг, циметидин 400 мг) или ингибиторов протонной помпы (ИПП) внутрь 1 раз в сутки до завтрака (лансопразол 30 мг, омепразол 20 мг, пантопразол 40 мг, рабепразол 20 мг).
Необходимо обращать внимание на длительность применения ИПП, поскольку долгосрочное лечение может вызывать ряд нежелательных эффектов — дефицит магния, гипергастринемию и риск развития опухолей, дефицит витамина B12, острый интерстициальный нефрит, остеопороз и повышенный риск возникновения переломов, синдром избыточного бактериального роста в кишечнике, усилить риск сердечно-сосудистых катастроф, повысить риск гепатотоксичности у больных циррозом печени.