Ранний детский возраст является пиком манифестации злокачественных новообразований эмбрионального происхождения. Своевременное выявление таких опухолей вызывает сложности у педиатров, поскольку некоторое время процесс протекает бессимптомно или маскируется под традиционные детские патологии — затяжные бронхиты, проблемы с ЖКТ, неврологические нарушения.
По данным статистики последних 2 лет, среди пациентов, направленных на обследование в РНПЦ детской онкологии, гематологии и иммунологии на поздних стадиях онкологических заболеваний (среди стадируемых опухолей), 42–47 % приходится на нейробластому. И хотя речь идет о единичных случаях, за каждым из них — успех лечения и качество жизни ребенка.
В связи с этим специалисты РНПЦ ДОГИ провели республиканскую школу-семинар, посвященный раннему выявлению нейробластомы у детей, с акцентом на клиническую симптоматику и визуальные методы обследования. Мероприятие прошло в онлайн-формате, в нем приняли участие врачи-педиатры, детские онкогематологи, неврологи, врачи ультразвуковой и лучевой диагностики из всех регионов республики.
Распространенность заболевания и группы риска
 Анжелика Солнцева, директор РНПЦ ДОГИ, доктор мед. наук, профессорОбщая заболеваемость злокачественными опухолями у детей относительно невелика и составляет примерно 1–2 случая на 10 000 детей. Примерно треть из них приходится на лейкозы. Если у взрослых 90 % опухолей связано с воздействием внешних факторов, то для детей несколько большее значение имеют генетические факторы. В настоящее время известно около 20 наследственных заболеваний с высоким риском развития злокачественной патологии.
Анжелика Солнцева, директор РНПЦ ДОГИ, доктор мед. наук, профессорОбщая заболеваемость злокачественными опухолями у детей относительно невелика и составляет примерно 1–2 случая на 10 000 детей. Примерно треть из них приходится на лейкозы. Если у взрослых 90 % опухолей связано с воздействием внешних факторов, то для детей несколько большее значение имеют генетические факторы. В настоящее время известно около 20 наследственных заболеваний с высоким риском развития злокачественной патологии.
В зависимости от возраста и типа выделяют 3 большие группы опухолей, встречающихся у детей: эмбриональные, ювенильные, опухоли взрослого типа. Эмбриональные опухоли возникают вследствие перерождения или ошибочного развития зародышевых клеток, что ведет к активному размножению этих клеток, гистологически сходных с тканями эмбриона или плода.
Нейробластома развивается из клеток-предшественников симпатической нервной системы и является самой частой злокачественной экстракраниальной солидной опухолью у детей раннего возраста. В более старшем возрасте составляет 7–8 % от всех злокачественных новообразований у детей и занимает 5-е место по частоте после острых лейкозов, опухолей ЦНС и злокачественных лимфом, опухолей почки.
В детском канцер-субрегистре Республики Беларусь с 1986 года зарегистрировано 535 случаев нейробластомы, в среднем в год выявляется 15–16 новых пациентов с этим заболеванием. Пик заболеваемости приходится на возраст от рождения до 3 лет — 75 %. В возрасте от 4 до 10 лет — 21 %, старше 11 лет — 4 %.
Совершенствование методов диагностики и лечения нейробластомы у детей до настоящего времени остается одной из важнейших задач современной онкопедиатрии.
Необходимость этого подчеркивается тем, что нейробластома занимает высокое место в структуре смертности детского населения в развитых странах, располагаясь на 3-м месте и уступая только лейкозам и опухолям ЦНС.
Нейробластома у детей представляет собой весьма гетерогенную группу опухолей, различающихся по морфологическим, биологическим, генетическим факторам, ответу на терапию и прогнозу. В большинстве случаев опухоль локализуется в забрюшинном пространстве, преимущественно в надпочечниках, реже — в средостении и на шее. В 45 % случаев речь идет о нейробластомах с неустановленной первичной локализацией, но уже имеющей отдаленные метастазы.
В раннем возрасте (до 18 месяцев) нейробластомы обладают удивительной способностью к спонтанному созреванию в доброкачественные ганглионевромы. Популяционные исследования свидетельствуют о том, что случаев спонтанных регрессий/созреваний этой опухоли у маленьких детей не меньше, чем частота, с которой развивается клинически диагностируемая нейробластома. Феномен спонтанного созревания отмечен не только у пациентов с локализованными формами, но и с распространенной 4S стадией.
Разделение на группы риска и проведение риск-адаптированной терапии позволяет, с одной стороны, добиться максимально возможного на данный момент процента излечения, а с другой — не перелечивать пациентов из групп с благоприятным прогнозом. Для групп низкого и промежуточного риска достигнуты результаты выживаемости, близкие к 100 %, исследования ведутся в плане возможной деэскалации терапии без уменьшения ее эффективности. Для группы высокого риска результаты продолжают оставаться неудовлетворительными, 5-летняя общая выживаемость составляет около 35 %, несмотря на использование всего арсенала, имеющегося в распоряжении детского онколога. Совершенствование подходов к лечению в этой группе — одна из основных задач детской онкологии.
Клиническая симптоматика
 Инна Пролесковская, заместитель директора по клинике РНПЦ ДОГИ, кандидат мед. наукПоловина опухолей при нейробластоме локализуется в надпочечниках, еще 50 % в паравертебральных ганглиях от шеи до копчика (забрюшинное пространство — 30 %, грудная клетка — 19 %, шея — около 1 %, таз — около 1 %). Поэтому клиническая симптоматика очень разнообразна.
Инна Пролесковская, заместитель директора по клинике РНПЦ ДОГИ, кандидат мед. наукПоловина опухолей при нейробластоме локализуется в надпочечниках, еще 50 % в паравертебральных ганглиях от шеи до копчика (забрюшинное пространство — 30 %, грудная клетка — 19 %, шея — около 1 %, таз — около 1 %). Поэтому клиническая симптоматика очень разнообразна.
Шея. Первичные нейробластомы шеи обычно неагрессивны и имеют хороший прогноз. Может пальпироваться одностороннее образование, у новорожденных имитирует тератому, что затрудняет диагностику. Если поражен звездчатый узел, развивается синдром Горнера (птоз, миоз, анофтальм, ангидроз). Могут быть экзофтальм орбиты, глаз, периорбитальные экхимозы («глаза енота»), пальпируемые образования, отек конъюнктивы, отек диска зрительного нерва, косоглазие, анизокория.
Периорбитальные экхимозы присутствуют примерно в 20 % случаев дессиминированной нейробластомы, метастатический процесс приводит к обструкции сосудов век и орбиты, поражению костей глазницы. Часто таких детей обследуют на предмет травмы, подозревая перелом основания черепа.
Грудная клетка. Первичные опухоли грудной клетки нередко обнаруживаются случайно при рентгенографии для оценки состояния по другим причинам. Клинические проявления при опухолях верхней части грудной клетки: длительно текущие бронхиты. Опухоли большого размера приводят к механической обструкции и как следствие — к синдрому верхней полой вены. Опухоли нижней части грудной клетки чаще всего бессимптомны.
Брюшная полость. Около 60 % первичных нейробластом возникают в брюшной полости (2/3 из надпочечников, 1/3 из паравертебральных ганглиев). Лишь 1/10 опухолей выявляются при обычном осмотре. Вначале пропальпировать опухоль сложно, т. к. она расположена забрюшинно. Клиническая симптоматика: боль в животе, чувство переполнения, редко кишечная непроходимость, возможно увеличение или смещение печени или селезенки.
У младенцев массивное поражение метастазами печени может привести к нарушению дыхания, респираторному дистресс-синдрому. Большой размер первичной или метастатической опухоли может стать причиной сдавления венозного или лимфатического оттока, приводя к отеку нижних конечностей и мошонки у мальчиков. В редких случаях развивается ренин-опосредованная гипертензия из-за сдавления сосудов почек. Абдоминальные нейробластомы, возникающие рядом с бифуркацией аорты, могут вызвать сдавление кишечника или мочевого пузыря (запоры, энурез).
Параспинальные опухоли в грудном, брюшном и тазовом отделах способны проникать в позвоночный канал через нервные отверстия (гантелевидная опухоль), вызывая компрессию спинного мозга. Спектр симптоматики: подострая или острая параплегия, дисфункция мочевого пузыря или кишечника, реже корешковая боль.
Хочу обратить особое внимание педиатров и неврологов на таких пациентов. Если ребенок рос и развивался нормально, а затем вдруг перестает ходить, жалуется на боли в ногах, теряет полученные навыки, нужно дополнительно его обследовать с применением визуализирующих методик. У нас были дети с диагностированной параплегией, при этом им не выполнялись дополнительные методы функциональной, ультразвуковой или лучевой диагностики.
На момент направления к нам дети уже не становились на ноги на протяжении 6–8 месяцев. У них выявлялась нейробластома, сдавливающая спинной мозг. Опухоль была успешно пролечена, но, к большому сожалению, при таком длительном сдавлении спинного мозга его функция полностью не восстанавливается. И при полной излеченности от онкологического заболевания сохраняется тяжелая неврологическая симптоматика.
Паранеопластический синдром встречается у 2 % пациентов, они имеют опсоклонус-миоклонус (миоклонические подергивания и беспорядочные движения глаз). Здесь также хочется привлечь внимание педиатров и неврологов, т. к. данный синдром ассоциируется с нейробластомой или же может существовать самостоятельно. Мы встречали детей, которые по 1,5–2 года лечились у неврологов и только затем попадали к нам. Выявлялась нейробластома, как правило, локальная, ее удаление в большинстве случаев приводило к полному излечения и от опухоли, и от синдрома опсоклонус-миоклонус.
Синдром хронической водной диареи при нейробластоме провоцируется автономной секрецией вазоактивного интестинального пептида. Поэтому дети со вздутием живота, длительным хроническим водянистым стулом нуждаются в дополнительном обследовании — УЗИ брюшной полости или МРТ брюшной полости для исключения нейробластомы. Особенно это касается детей до 4 лет.
Для метастатического процесса при нейробластоме характерны: лихорадка, потеря веса, боли в ногах, анемия, геморрагический синдром.
Прогноз при нейробластоме зависит от возраста пациента, стадии заболевания, гистологических и цитогенетических характеристик опухоли. Выделяют 3 группы риска — низкого (группа наблюдения), промежуточного и высокого. У пациентов группы наблюдения в 40 % случаев встречается феномен спонтанного созревания опухоли. Для их терапии используют хирургический метод лечения и/или низкодозную химиотерапию.
Пятилетняя бессобытийная выживаемость составляет 93 %. В лечении пациентов группы промежуточного риска применяется комплексный подход (химиотерапия, хирургия и при необходимости лучевая терапия), что позволяет достичь 5-летней бессобытийной выживаемости 80 %. Для группы высокого риска применяется мультимодальная терапия, включающая полихимиотерапию, хирургическое лечение, МИБГ-терапию, высокодозную полихимиотерапию с поддержкой аутологичной стволовой клеткой и лучевую терапию. Все эти методы позволяют добиться 5-летней выживаемости 38–40 %. Поэтому особенно актуальным является вопрос диагностики заболевания на более ранних этапах.
Ультразвуковая диагностика
 Игорь Бегун, заведующий отделением функциональной диагностики РНПЦ ДОГИ, кандидат мед. наукПервичная диагностика нейробластомы может оказаться затруднительной.
Игорь Бегун, заведующий отделением функциональной диагностики РНПЦ ДОГИ, кандидат мед. наукПервичная диагностика нейробластомы может оказаться затруднительной.
К сожалению, у значительной части пациентов на момент постановки диагноза болезнь уже в распространенной форме. Чаще всего опухоль распространяется в лимфатические узлы, печень, кости и костный мозг (см. рис. 1).
Хотя окончательный диагноз нейробластомы выносится на основе биопсии, взятой во время операции, впервые эту опухоль обнаруживает врач УЗД при скрининговом исследовании плода, на профилактическом осмотре или при обследовании ребенка, которого привели с конкретными жалобами.
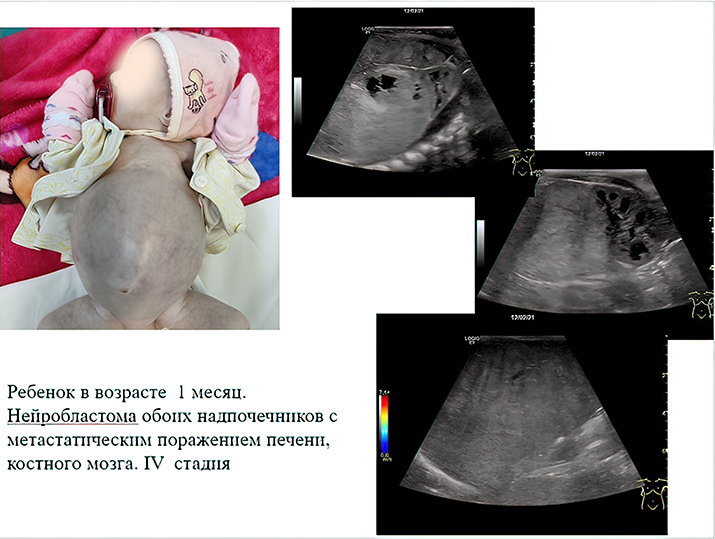
Во время УЗИ на амбулаторном этапе забрюшинная опухоль, как правило, определяется по достижении так называемого диагностического объема в несколько кубических сантиметров. При этом врач уверенно может установить факт наличия образования, его эхоструктуру, чего уже достаточно для направления ребенка на дообследование (см. рис 2).
Рисунок 2. Сонографические варианты нейробластомы.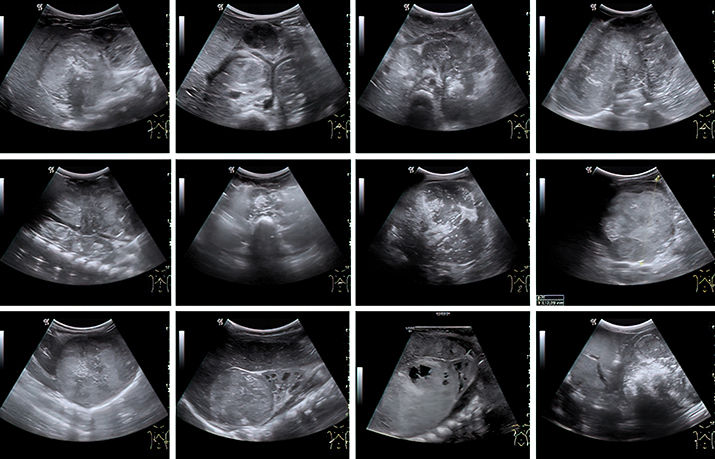 Наибольшие трудности специалист УЗД испытывает при установлении органной принадлежности опухоли, когда она уже достигла больших размеров. К примеру, медиана диагностического объема впервые установленной нейробластомы у младенца составляет 75 (26–208) см3, а для опухоли почки и того больше — 317 (226–524) см3. Именно эти новообразования приходится дифференцировать, в том числе и в онкологическом центре, т. к. химиотерапевтическое лечение опухоли Вильмса в ряде случаев начинают по результатам диагностики на основе визуализирующих методов исследования.
Наибольшие трудности специалист УЗД испытывает при установлении органной принадлежности опухоли, когда она уже достигла больших размеров. К примеру, медиана диагностического объема впервые установленной нейробластомы у младенца составляет 75 (26–208) см3, а для опухоли почки и того больше — 317 (226–524) см3. Именно эти новообразования приходится дифференцировать, в том числе и в онкологическом центре, т. к. химиотерапевтическое лечение опухоли Вильмса в ряде случаев начинают по результатам диагностики на основе визуализирующих методов исследования.
Мы задались целью определить возрастной интервал у грудного ребенка, когда диагностический ультразвук, даже по Fast-протоколу исследования, будет достаточно эффективен для выявления забрюшинного образования и в то же время будет возможность провести профилактическую диагностику других органов по направлению ортопеда, невролога, кардиолога.
Путем анализа пренатальных случаев диагностики, обратной экстраполяции объема опухоли в группе наших пациентов в возрасте до года и при помощи математического моделирования было установлено, что опухоль начинает расти еще до рождения и достигает своего диагностического объема в нераспространенной стадии к 3–4 месяцам жизни. Это обусловлено высокой скоростью роста эмбриональных опухолей, к которым относится нейробластома, — период удвоения объема этих опухолей варьирует в зависимости от возраста, например, у детей грудного возраста нами установлена медиана его значения 32,2 (20,3–44,5) дня.
Примерно за месяц размер опухоли удваивается!
К сожалению, на амбулаторном этапе диагностический период в силу разных причин затягивается от 2 недель до более месяца (2/3 случаев), за это время опухоль как минимум удваивает свой объем и может перейти в распространенную форму.
Среди причин удлинения диагностического периода можно выделить ситуацию с затратными по времени промежуточными уточняющими консультациями, когда в силу редкости онкологических заболеваний у детей специалист УЗД не всегда точно может сформулировать тактику уточняющей диагностики по результатам своего исследования. Но условия для улучшения качества своевременной и ранней диагностики новообразований у детей есть.
Практически в каждой поликлинике и медцентре республики работает кабинет УЗД, в котором принимает специалист, занимающий должность врача. Стандартизированы протоколы исследования органов и систем. Растет уровень доверия населения к этому безопасному, доступному, информативному методу визуализации. Все чаще сами родители приводят маленького пациента на обследование, когда «что-то не так».
Методы лучевой диагностики
 Елена Руцкая, заведующая отделением лучевой диагностики РНПЦ ДОГИ, кандидат мед. наукЛучевая диагностика применяется для выявления, локализации нейробластомы и других нейроэндокринных опухолей, оценки их тканевых характеристик, определения распространенности опухолевого процесса, контроля регрессии опухоли на этапах полихимиотерапии (ПХТ) или рецидива в динамике.
Елена Руцкая, заведующая отделением лучевой диагностики РНПЦ ДОГИ, кандидат мед. наукЛучевая диагностика применяется для выявления, локализации нейробластомы и других нейроэндокринных опухолей, оценки их тканевых характеристик, определения распространенности опухолевого процесса, контроля регрессии опухоли на этапах полихимиотерапии (ПХТ) или рецидива в динамике.
Основными визуализирующими методами являются компьютерная томография (КТ), КТ-ангиография, МРТ с контрастированием — они позволяют получить визуальные данные о местной распространенности локализованного опухолевого процесса и его генерализации, что относится к важному прогностическому фактору при выборе оптимального объема специальной комбинированной терапии, оценке рисков радикальности хирургического лечения и исхода заболевания.
Тканевыми характеристиками нейробластомы являются: мягкотканная масса +25+35 HU на КТ (снимок 1), с гипоинтенсивным МР-сигналом на Т1-ВИ, изо/слабогиперинтенсивным сигналом на Т2, Т2 dark fluid — ВИ (снимок 2), негомогенная за счет кровоизлияний, очаговой кальцинации и некротических изменений, с умеренным контрастированием в паренхиматозную фазу, умеренной рестрикцией диффузии на МРТ.
Современная методика МРТ-диффузионного исследования всего тела нацелена на поиск метастазов опухоли. Радионуклидное исследование с I123-метайодбензилгуанидином (MIBG) выявляет и уточняет жизнеспособность опухоли с наибольшей чувствительностью (90 %) и специфичностью (до 100 %). Позитронно-эмиссионная томография с фтордезоксиглюкозой (ПЭТ-ФДГ) используется для дифференциальной диагностики нейроэндокринных опухолей.
В руководстве Международной группы по изучению нейробластомы (Guidelines International Neuroblastoma Risk Group INRG-2009) предложена новая система стадирования опухоли, основанная исключительно на визуально определяемых признаках риска (Image Defined Risk Factors IDRF Staging System), а не на постоперационных данных, которые использовались в классификациях до недавнего времени.
Чаще всего нейробластома локализуется паравертебрально в реберно-позвоночной борозде по ходу симпатических ганглиев: в забрюшинном пространстве, надпочечниках, заднем средостении (снимок 3), полости таза, в области шеи. Генерализация опухоли с метастазированием в кости выявляется в 20 % случаев, в печень — 10 %, реже в легкие, головной мозг, подкожную клетчатку, при этом характерно поражение периорбитальных мягких тканей (1–5 %).
К наиболее важным визуально определяемым признакам опухоли (IDRF) относятся: поражение двух и более частей тела, вовлечение в опухоль более 50 % периметра артериального сосуда
(снимок 4), сдавление вены без визуализации ее просвета, инфильтрация прилежащего органа (снимок 5), компрессия трахеи и главных бронхов, инвазия сосудистых ножек почек, распространение в спинно-мозговой канал более трети просвета (снимок 6).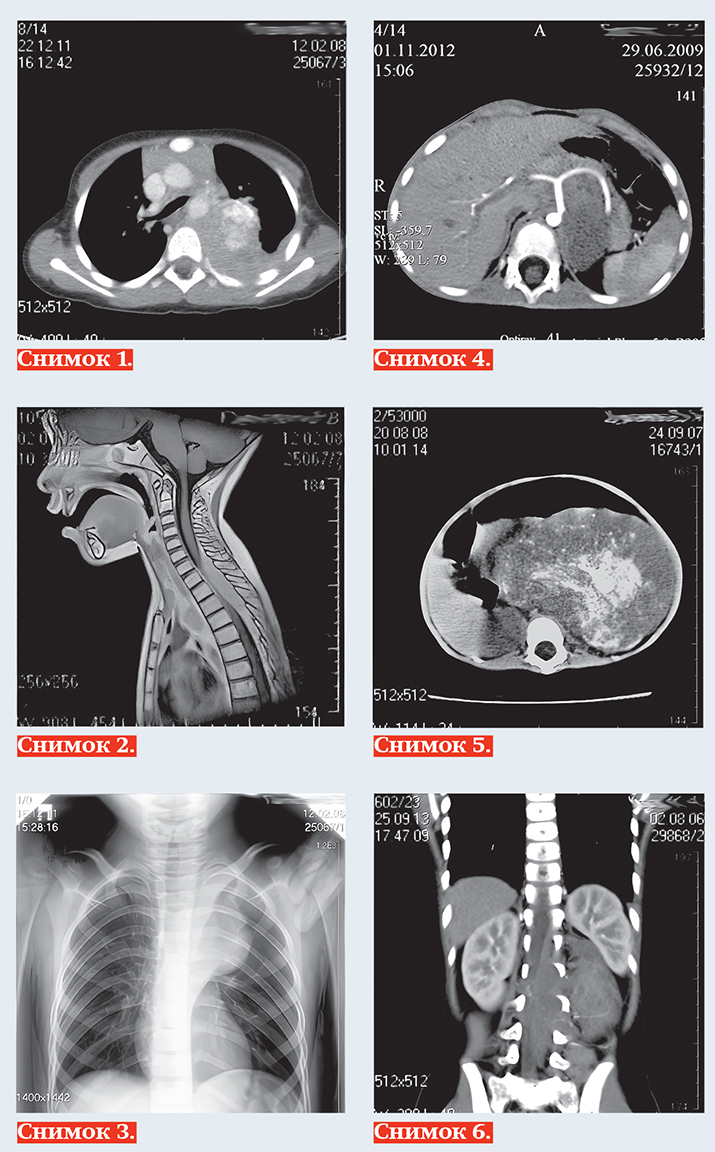
Отдаленные последствия противоопухолевого лечения
 Марина Борисевич, заместитель директора по организационно-методической работе РНПЦ ДОГИ, кандидат мед. наукЗа последние 20 лет успехи детских онкогематологов, связанные с увеличением показателя выживаемости, привели к растущему числу лиц трудоспособного возраста, излечившихся от злокачественного новообразования в детстве. Наблюдение и изучение состояния здоровья и качества жизни этой группы людей является актуальным направлением исследований в последние 10–15 лет.
Марина Борисевич, заместитель директора по организационно-методической работе РНПЦ ДОГИ, кандидат мед. наукЗа последние 20 лет успехи детских онкогематологов, связанные с увеличением показателя выживаемости, привели к растущему числу лиц трудоспособного возраста, излечившихся от злокачественного новообразования в детстве. Наблюдение и изучение состояния здоровья и качества жизни этой группы людей является актуальным направлением исследований в последние 10–15 лет.
Врачи-специалисты первичного звена делают упор на оценку качества ремиссии по онкологическому заболеванию, упуская из виду отдаленные осложнения. Это происходит по причине отсутствия знаний о механизмах негативного влияния основных видов противоопухолевой терапии. Для лечения пациентов с нейробластомой используются агрессивные методы: полихимиотерапия, лучевая терапия, хирургическое удаление, высокодозная полихимиотерапия с аутотрансплантацией ГСК. Среди цитостатических лекарственных средств, применяемых для лечения пациентов с нейробластомой, используются препараты платины, классические алкилирующие агенты, антрациклины, винкаалкалоиды, этопозид.
При наблюдении за пациентами, излеченными от нейробластомы в детском возрасте, спустя 5 и более лет в 75 % случаев выявлены отдаленные осложнения. Чаще всего диагностировались эндокринные заболевания, болезни нервной системы и опорно-двигательного аппарата.
У 20 % пациентов были выявлены более 3 событий, связанных с отдаленными последствиями противоопухолевого лечения. Речь идет о так называемом накопительном эффекте при возникновении осложнений в отдаленном периоде. Все это следует учитывать при диспансеризации населения после перенесенных онкологических заболеваний. Персонифицированный подход и своевременность профилактических мероприятий, направленных на снижение тяжести инвалидности, имеют огромную социальную и экономическую значимость.
Основной задачей, которая стоит перед детскими онкологами, является оптимизация противоопухолевой терапии, направленная на снижение токсичности и предупреждение отдаленных последствий лечения, без снижения показателя выживаемости. Специалисты вынуждены балансировать между успехом от проводимого лечения с выраженной токсичностью и сохранением качества жизни пациентов.
Возможные способы снижения запущенных случаев
Инна Пролесковская:
— В некоторых странах, например, Германии, Японии, Канаде, проводились скрининговые программы с определением уровня катехоламинов в моче у новорожденных в роддомах. Тест простой: моча наносится на специальную бумагу, с помощью иммунной хроматографии определяется концентрация ГВК, МВК. Это увеличило выявление нейробластомы у детей до года, которые имеют благоприятный прогноз, в т. ч. спонтанного разрешения опухолей. Родители таких детей нередко подавали судебные иски к исследователям за нарушение психологического комфорта. В целом такой скрининг не привел к снижению смертности от нейробластомы.
В Германии провели исследование, включив в скрининг детей в возрасте 18 месяцев. Количество выявленных случаев нейробластомы увеличилось, но смертность в группе высокого риска не уменьшилась.
По данным ВОЗ, скрининговые программы по выявлению злокачественных новообразований у детей, в отличие от взрослых, малоэффективны. Предположительно это объясняется эмбриональной природой большинства опухолей у детей до 4–5 лет.
По мнению специалистов нашего центра, достаточно доступным и безопасным методом для раннего выявления нейробластомы является УЗИ. Возможно, выполнение всем детям в возрасте около 1 года УЗИ брюшной полости помогло бы снизить количество эмбриональных опухолей в запущенных стадиях. У нас есть определенные предпосылки так думать.
Большое значение имеет грамотная диспансеризация, внимание педиатров на приеме. Конечно, при большом потоке пациентов внимание рассеивается. Но все же хочется призвать к тому, чтобы педиатрический прием не ограничивался осмотром ротовой полости и аускультацией легких. Маленького пациента обязательно надо раздевать, укладывать на кушетку, пальпировать брюшную полость, лимфоузлы. И если что-то не укладывается в рамки предполагаемого диагноза, нужно искать ответы на свои вопросы, назначать дополнительные обследования для выявления патологии.
Игорь Бегун:
— Для сокращения диагностического периода в детской онкологической практике решение видится в создании консультационного онлайн-центра, где будут размещены полезные ресурсы. Для родительской аудитории — это просветительские и мотивационные публикации. Для специалистов — гибкий доступ к информационно-аналитическим сервисам: от качественного атласа (видеотеки) верифицированных ультразвуковых диагностических изображений нозологических форм детского рака на ранних и продвинутых стадиях до систем поддержки принятия врачебного решения с использованием искусственного интеллекта и алгоритмизированных моделей, позволяющих дифференцировать заболевание по комплексу морфометрических признаков в количественном выражении.
Как прототип алгоритмического раздела можно привести известную систему стратификации узловой патологии щитовидной железы TIRADS. Автоматическая обработка представленного диагностического изображения, оперативное заполнение протокола исследования по привычному алгоритму позволит врачу в режиме реального времени рассчитать допустимую вероятность наличия того или иного заболевания у конкретного пациента и своевременно направить его в профильное лечебное учреждение.
Таким образом, время от первого диагностического УЗИ до госпитализации в специализированный стационар значительно сократится, а квалификация врачей-диагностов при наличии обратной связи с референтным учреждением будет расти. Практическая реализация концепции и масштабирование внедрения позволит снизить количество запущенных форм злокачественных новообразований у детей за счет сокращения времени от появления первых симптомов заболевания до постановки диагноза.
