О ранней диагностике рака молочной железы и важности роли акушера-гинеколога в профилактике этого заболевания рассказала Елена Савоневич, доцент кафедры акушерства и гинекологии ГрГМУ, кандидат мед. наук.
Рост онкопатологии органов женской репродуктивной системы
 Елена СавоневичСреди всех онкологических заболеваний рак молочной железы (РМЖ) занимает второе место по частоте встречаемости, а среди женского населения он лидирует.
Елена СавоневичСреди всех онкологических заболеваний рак молочной железы (РМЖ) занимает второе место по частоте встречаемости, а среди женского населения он лидирует.
В Беларуси частота РМЖ в структуре онкопатологии достигает 22 % (данные Globocan, 2020), что определяет особую актуальность профилактики.
Тенденции развития современной медицины связаны с 4П-концепцией, построенной на принципах персонализированного подхода, предикции (создания вероятностного прогноза), партисипативности (мотивированного участия пациента) и превентивности (предотвращения появления заболевания).
4П-медицина стратегически и тактически отличается от общепринятых клинических подходов. Она направлена на снижение заболеваемости и способна реально стабилизировать этот показатель, снизить инвалидизацию трудоспособного населения, существенно сократив традиционно высокие расходы на лечение уже заболевших людей. 4П-медицина ведет к смене парадигмы здравоохранения: от специального лечения — к профилактике, от болезни — к здоровью конкретного пациента.
Очень важно понимать, как и почему может возникнуть РМЖ. Доказана роль дисгормональных изменений в организме. Они, как правило, незаметны для женщины и могут сохраняться годами. Развитие патологии молочных желез связано не столько с увеличением или уменьшением концентрации отдельных гормонов, сколько с нарушением ритма их выделения и изменением их соотношения в организме. Заболевание может развиваться как на фоне гормональной недостаточности, так и в результате длительной внешней стимуляции.
При этом если эстрогены могут вызывать пролиферацию протоков молочной железы и их соединительной ткани самостоятельно, то прогестерон может приводить к трансформациям в ткани только в присутствии эстрогенов. Поэтому особую важность имеет гормональный баланс и так называемая гармония гормонов. Девочки попадают в ситуацию гормонального дисбаланса, связанного с преобладанием эстрогенов, еще в ювенильный период, когда происходит становление менструального цикла. И даже идеально здоровая девушка будет иметь такой период, но непродолжительный.
Второй период максимальной уязвимости молочной железы у женщины — перименопауза, когда в силу угасания функции яичников опять у всех женщин появляется относительная гиперэстрогения и так называемое открытое эстрогенное окно. Частота развития патологии напрямую связана со структурными особенностями молочных желез, которая определяется уже личным репродуктивным анамнезом.
В 1997 году швейцарские ученые опубликовали результаты изучения развития фиброаденом и фиброзно-кистозной мастопатии на большой группе женщин. Оказалось, что пик заболеваемости фиброаденомами приходится на 20–24 года, т. е. по сути пролиферативные доброкачественные образования в молочных железах начинают формироваться уже от момента появления менструальной функции.
Фиброзно-кистозная мастопатия, вероятно, имеет другой вариант развития, так как пик этого заболевания приходится на перименопаузальный возраст.
Этапы канцерогенеза
Традиционное представление о раке основывается на том, что нормальные клетки после серии мутаций начинают бесконтрольно размножаться, в результате образуется опухоль. Отдельные клетки этой опухоли могут мигрировать, делиться, давать метастазы...
Установлено, что канцерогенез имеет длительную преклиническую фазу. Это открывает новые возможности для более раннего выявления патологии. Заболеваемость инвазивным РМЖ в возрасте 40–50 лет, по данным статистики, составляет 1 %. В то же время при тщательном исследовании ткани молочной железы на вскрытии женщин, умерших от других причин в возрасте 40–50 лет, начальные формы РМЖ (cancer in situ) были обнаружены в 39 % случаев.
Основная идея концепции 4П-медицины базируется на достижениях в области геномики, транскриптомики, биоинформатики. Последние научные исследования посвящены не столько мутациям, сколько эпигенетическим изменениям в клетках, т. к. эпигенетика — это, по сути, «подготовка почвы», создание условий для возникновения мутации и опухолевого процесса.
Современный взгляд на процесс развития рака включает три этапа. На первом этапе возникает нарушение баланса эстрогенов и прогестерона (эпигенетические изменения в клетках ткани, которые приводят к созданию условий и запускают раковую трансформацию, но роста опухоли еще не происходит, просто формируются подходящие условия). На втором происходят функциональные нарушения в молочной железе (появляется мутация, и это обычно считается началом развития опухолевого процесса). На третьем этапе происходят морфологические изменения, формируется сама опухоль. Интересно, что она имеет генетическую и эпигенетическую гетерогенность по той причине, что эпигенетика и генетические свойства клетки передаются не из поколения в поколение, как передаются мутации, а от клетки к клетке. Поэтому первичная клетка с определенными эпигенетическими нарушениями, которые касались регуляции активности нормальных генов, сохраняет свою память и, трансформируясь в раковую, приобретает свой индивидуальный характер.
По факту образовавшаяся гетерогенная опухоль не будет одинаково подвергаться одному и тому же варианту лечения.
Таким образом, любой патологический процесс в молочной железе может быть началом опухоли, будь то мастопатия, масталгия, высокая маммографическая плотность при отсутствии жалоб со стороны пациентки.
Основные факторы риска
Все факторы риска рака молочной железы условно можно разделить:
- на генетическую предрасположенность, отягощенный семейный онкоанамнез,
- репродуктивные/гормональные,
- экзогенные, в т. ч. образ жизни,
- связанные с патологией молочных желез.
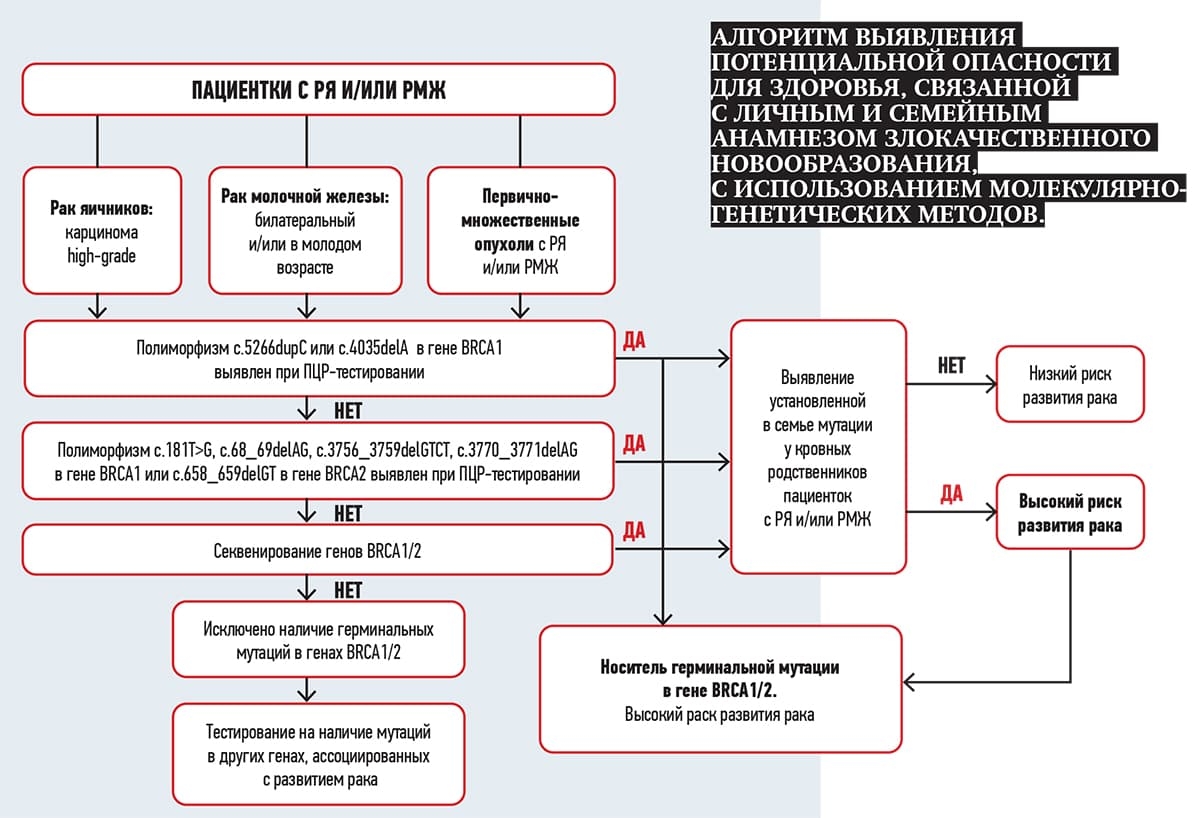
Семейный анамнез имеет большое значение в выявлении генетической предрасположенности. К клиническим признакам наследственного рака относят наличие в семейном анамнезе РМЖ или рака яичников (РЯ), первично-множественных опухолей у ближайших кровных родственников, молодой возраст заболевания (до 45 лет) у родственников, случаи билатерального рака в семье, РМЖ у мужчины.
Гены, ассоциированные с развитием РМЖ, и спектр герминальных мутаций достаточно хорошо описаны в научной литературе, но имеют значительные географические различия. Из известных нам среди славянского населения доминируют мутации в генах BRCA (порядка 60 %). Но наука не стоит на месте, и эти данные постоянно обновляются.
Риск развития рака у носителя мутации повышается в десятки раз, у женщин достигает 90 % к возрасту 70–75 лет, в то время как в возрасте 50 лет раком молочной железы носитель мутации рискует заболеть в 50 % случаев.
Гинекологи, имея информацию о наличии генетической предрасположенности у здоровой женщины, могут помочь модифицировать риски и снизить их в 2–3 раза в первую очередь за счет правильного репродуктивного поведения. Объяснить это женщинам нужно как можно раньше.
Риск развития РМЖ имеет прямую связь с возрастом у носителей мутации в генах BRCA 1/2, но самые ранние случаи фиксируются уже в 25–28 лет. Поэтому информация о наследственной предрасположенности, тем более подтвержденная молекулярно-генетическими тестами, должна активно использоваться в работе со здоровыми носителями мутации.
Гены BRCA 1 и BRCA 2 по-разному влияют на риск развития онкопатологии: BRCA 1 скорее будет повышать риски по развитию РЯ, а BRCA 2 — РМЖ.
Нами изучен полный спектр мутаций в генах BRCA 1 и BRCA 2 методом NGS-секвенирования у пациенток с раком яичников и РМЖ.
Интересно, что в белорусской популяции, в частности, в Гродненском регионе до 70 % всех носителей мутаций имеют порядка 5–6 мутаций, которые могут быть выявлены простыми ПЦР-тестами.
Эти тесты доступны для всех в коммерческих лабораториях. То есть если у человека есть отягощенный семейный или личный онкоанамнез, ему нужно рекомендовать пройти обследование. Желательно начинать обследование с заболевшего родственника, если это возможно. Таким образом у 70 % женщин с генетической предрасположенностью к развитию онкопатологии можно либо выявить мутацию, либо исключить наличие определенных мутаций в гене BRCA 1/2.

Профилактика
Для выбора индивидуального варианта и последовательности мер профилактики необходимо оценить:
- наличие герминальной мутации в генах BRCA,
- семейный онкоанамнез,
- факторы и степень риска,
- возраст,
- менопаузальный статус,
- сопутствующие заболевания,
- предпочтения женщины.
Принципиально важно объяснять здоровым женщинам с наследственной предрасположенностью преимущества и недостатки тех или иных профилактических мер. Так, своевременное выполнение профилактической операции по удалению яичников снижает риск развития онкопатологии на 99 % по РЯ и на 70 % по РМЖ, если оварэктомия выполняется до 40–45 лет. При этом важно, что в случае отсутствия минимальных признаков наличия опухоли по результатам гистологического исследования женщине может быть назначена менопаузальная гормональная терапия, которая компенсирует преждевременную утрату функции яичников и сохранит качество жизни.
Самая эффективная профилактика РМЖ на сегодняшний день — риск-редуцирующая (профилактическая) мастэктомия. Тем, кто молод либо не готов к такому варианту профилактики рака, надо предлагать наблюдение, но пояснять, что, к сожалению, в таком случае невозможно гарантировать раннюю диагностику злокачественной опухоли в молочной железе.
Репродуктивные и гормональные факторы риска развития РМЖ: многочисленные метаанализы демонстрируют значимую связь рака с отсутствием грудного вскармливания в анамнезе, менопаузой в возрасте после 50 лет, менархе до 13 лет, постменопаузой, возрастом первой беременности более 25 лет, семейным онкоанамнезом по РМЖ.
Доказано, что даже при отсутствии грудного вскармливания каждые роды снижают риск онкозаболевания на 7 %. Роды в возрасте до 20 лет снижают риск развития РМЖ на 50 % даже у женщин с генетической предрасположенностью к раку. Лактация в течение года снижает риск развития РМЖ на 4,3 %.
Во время первой беременности молочная железа проходит важные этапы формирования. В 1-м триместре происходит разрастание млечных протоков, повышена митотическая активность, пролиферация эпителия. Во 2–3-м триместрах преобладают процессы морфофункциональной дифференцировки, связанные с секреторной активностью, и трансформация долек железы.
Поэтому, анализируя репродуктивную историю женщины, необходимо смотреть не только на возраст первой менструации и первой беременности, первой лактации, но и на наличие абортов, выкидышей, нарушений менструального цикла с приемом гормональных контрацептивов, гормональной терапии, которая до первой беременности и лактации негативно влияет на молочные железы.
Среди имеющих доброкачественную патологию молочных желез женщин 90 % — гинекологические пациентки, так как пролиферативные дисгормональные заболевания органов репродуктивной системы имеют схожий патогенез. При миоме матки и генитальном эндометриозе доброкачественные заболевания в молочной железе рано или поздно будут обнаружены практически у всех (94 %).
Экзогенные факторы риска патологии молочных желез — это внешняя среда и образ жизни:
- психоэмоциональный дистресс (подавленное настроение, выраженное беспокойство, выраженная эмоциональная лабильность, апатия, раздражительность, сонливость или бессонница, снижение интереса в повседневной жизни),
- злоупотребление алкоголем,
- нарушение биологических ритмов сна/бодрствования (например, работа в ночную смену),
- курение,
- низкая физическая нагрузка,
- особенности питания (доказано, что ожирение повышает риск РМЖ, но только в постменопаузу).
Диагностика
Что делать гинекологу:
1. Расспросить пациентку и провести объективное обследование молочных желез.
2. Осмотреть и пальпировать молочные железы.
3. Идентифицировать факторы риска онкопатологии.
Пальпация: оптимальное время для осмотра — первая или начало второй недели менструального цикла, так как в это время минимизированы отек и структурные изменения, вызванные влиянием гестагенов на молочные железы.
Положение пациентки — стоя, а также лежа на спине и на боку. Оцениваются симметричность расположения и формы молочных желез, уровень стояния сосков и состояние кожного покрова.
При пальпации определяют локализацию, размеры, границы опухоли, ее поверхность и консистенцию, а также взаимоотношение с окружающими тканями и смещаемость по отношению к ним. Обязательно нужно исследовать лимфоузлы и наличие выделений из сосков молочных желез.
У 5–6 % женщин встречаются выделения из молочных желез. В случае серозных, серозно-геморрагических, геморрагических выделений либо выделений только из одной груди показаны взятие мазка для цитологического исследования и консультация онколога.
Гормональное обследование рекомендовано только при нарушениях менструального цикла и клинических признаках заболеваний щитовидной железы с целью уточнения диагноза и определения метода терапии.
При наличии галактореи необходимо выполнить тест на беременность, исследовать уровень пролактина. Важно исключить прием препаратов, которые могут быть причиной галактореи (метоклопрамид, верапамил, комбинированные оральные контрацептивы и др.).
Инструментальные обследования: УЗИ с эластографией либо маммография, по показаниям — МРТ молочных желез. Показания/противопоказания к применению инвазивных методов диагностики, тонкоигольной аспирационной биопсии, прицельной трепанобиопсии должны устанавливаться врачом-онкологом.
Что должен делать гинеколог при выявлении патологии?
Женщины, у которых выявлены кистозные или узловые изменения молочных желез, должны быть направлены в онкологический диспансер для уточнения диагноза.
После исключения злокачественных новообразований женщины с доброкачественными заболеваниями молочной железы наблюдаются у акушера-гинеколога, но он должен иметь заключение, рекомендацию маммолога/онколога. Если узловое образование было удалено из молочной железы, обязательно надо получить результаты гистологического исследования.
Врач-акушер-гинеколог может назначить терапию гинекологических заболеваний только пациенткам с диффузной формой мастопатии. Это принципиально важно. Молочная железа обязательно должна быть обследована перед назначением гормональной терапии, оральной контрацепции, тем более на длительный срок. При выявлении очаговой патологии гормональная терапия может быть начата только после консультации у онколога-маммолога.
Выбор лекарственных препаратов
При наличии доброкачественных заболеваний молочной железы женщине можно предложить наблюдение и лечение, в т. ч. медикаментозными препаратами.
Гормональная терапия требует индивидуального подхода. При наличии гипофункции желтого тела правильным будет назначить трансдермально гестагены, рекомендуется принимать их в течение месяца непрерывно, а не во вторую фазу цикла.
При гиперпролактинемии — агонисты дофамина, при гипофункции щитовидной железы — левотироксин/эутирокс (3–6 месяцев).
Тамоксифен, как селективный модулятор эстрогеновых рецепторов, должен назначать уже врач-онколог для медикаментозной профилактики РМЖ у носителей герминальных мутаций BRCA 1/2.
К методам негормональной терапии относятся НПВП, мочегонные, фитотерапия, гомеопатия, витамины и препараты на основе индол-3-карбинола (индинол, индинол форте), которые являются универсальными корректорами патологических гиперпластических процессов в тканях молочной железы и всей репродуктивной системы.
Клинический случай РМЖ, которого могло не быть
Пациентка с 3 беременностями и 2 родами в анамнезе. ИМТ 21.
Семейный онкоанамнез отягощен колоректальным раком у отца.
В течение 7 лет после родов принимала комбинированные оральные контрацептивы, которые были назначены в связи с нарушением менструального цикла в 30 лет.
В 34 года при плановом УЗИ молочных желез была выявлена фиброаденома молочной железы. К сожалению, никто из врачей не объяснил пациентке риски и не настоял на своевременном хирургическом лечении доброкачественной патологии.
Секторальная резекция проведена лишь в 37 лет. По результатам гистологического исследования выявлена инвазивная неспецифическая карцинома. После радикального хирургического лечения обнаружены 3 метастатически пораженных лимфоузла. Доброкачественное образование в молочной железе на фоне длительной комбинированной оральной контрацепции трансформировалось в гормонозависимый рак молочной железы IIIa стадии.