Первичные иммунодефициты (ПИД, врожденные ошибки иммунитета) — это генетические заболевания, которые влияют на развитие и функцию иммунной системы, тем самым повышая восприимчивость к инфекционным патогенам, аутоиммунитету и злокачественным новообразованиям.
 Самой серьезной и жизнеугрожающей формой ПИД является тяжелая комбинированная иммунная недостаточность (ТКИН), сочетающая отсутствие функций Т- и В-лимфоцитов, что приводит к тяжелым инфекциям с первых месяцев жизни. Поздняя диагностика ТКИН и, как результат, отсутствие своевременного лечения нередко приводят к младенческой смертности на первом году жизни ребенка.
Самой серьезной и жизнеугрожающей формой ПИД является тяжелая комбинированная иммунная недостаточность (ТКИН), сочетающая отсутствие функций Т- и В-лимфоцитов, что приводит к тяжелым инфекциям с первых месяцев жизни. Поздняя диагностика ТКИН и, как результат, отсутствие своевременного лечения нередко приводят к младенческой смертности на первом году жизни ребенка.
Согласно мировым данным, ранняя диагностика посредством скрининга новорожденных позволяет начать своевременное лечение с достижением высоких показателей выживаемости. В отличие от индивидуального персонифицированного клинического обследования скрининговый тест дает возможность заподозрить редкое, но серьезное состояние еще до развития клинических проявлений.
Причины ПИД
ПИД является наследственным заболеванием, то есть передается в семьях так же, как фенотипические характеристики, такие как цвет глаз, передаются от родителей к ребенку. Это вызвано ошибкой (мутацией) в генетической последовательности ДНК.
Определение генетической причины важно не только для установления диагноза, но и для генетического консультирования членов семьи. Генетические дефекты могут быть унаследованы от родителей или могут быть связаны со спонтанными мутациями (de novо).
При ТКИН генетическое нарушение в последовательности ДНК может быть унаследовано либо как Х-сцепленный (сцепленный с полом) дефект, когда ген наследуется от матери, в таком случае вероятность рождения больного ребенка составляет 50 % и болеют только мальчики, либо как дефект с аутосомно-рецессивным типом наследования, при котором дефектный ген наследуется от обоих родителей и в 25 % случаев вызывает заболевание у детей обоего пола.
Дефицит клеточного и гуморального иммунитета
Младенцы с ТКИН, как правило, выглядят здоровыми при рождении, но очень восприимчивы к тяжелым, угрожающим жизни вирусным, бактериальным и грибковым инфекциям.
Согласно мировым данным, за последние годы из крайне редких заболеваний с дебютом в раннем возрасте ПИД концептуально превратились в относительно распространенные заболевания нарушенного контроля за иммунным гомеостазом, которые могут проявиться самой различной симптоматикой.
Еще 5 лет назад считалось, что частота ТКИН составляет 1:100 000, однако внедрение неонатального скрининга на выявление ПИД, которое проводится с 2018 года во всех штатах США и более чем в 20 европейских странах, позволило получить более точную оценку встречаемости, которая составляет 1:10 000–28 000.
Единственным методом лечения для таких пациентов является трансплантация гемопоэтических стволовых клеток (ТГСК), позволяющая не только сохранить жизнь, но и обеспечить ее качество, если она проведена своевременно.
Ранняя диагностика и лечение играют решающую роль в выживании пациентов. Возможность выявления у новорожденных детей ПИД, обусловленных наличием генетического дефекта, — актуальный запрос современной медицины во всем мире, в том числе и в Республике Беларусь.
В этом может помочь только неонатальный скрининг, показавший высокую эффективность в тех странах, где он проводится.

Диагностика врожденных ошибок иммунитета
Одним из перспективных и высокоэффективных методов выявления ПИД и других форм лимфопении является метод количественного определения кольцевых фрагментов ДНК Т- и В-клеточных рецепторов TREC и KREC (с англ. T-cell receptor excision circles (TREC) — эксцизионное кольцо Т-клеточного рецептора и Kappa-deleting recombination excision circles (KREC) — эксцизионное кольцо делеционного элемента иммуноглобулина каппа), которые являются маркерами новообразовавшихся T- и В-лимфоцитов. Благодаря наличию в составе TREC и KREC консервативных последовательностей ДНК их удается определить с помощью ПЦР.
В мире существует несколько тест-систем, некоторые из них используются для определения только TREC, некоторые для одновременного определения и TREС, и KREC, что является наиболее оптимальным, так как позволяет выявить не только Т-, но и В-клеточную лимфопению.
Скрининговые исследования с использованием TREC и KREC успешно применяются в США, Италии, Швеции, Германии, Нидерландах, Франции, Испании, Норвегии. В России недавно утверждена государственная программа скрининга ПИД, планируется внедрение данного метода.
В Беларуси существует собственный метод количественного определения кольцевых фрагментов ДНК Т- и В-клеточного рецептора (TREC/KREC) посредством ПЦР в режиме реального времени, разработанный на базе РНПЦ ДОГИ.
Метод обладает высокой эффективностью, чувствительностью и специфичностью в отношении определения дефицита Т- и В-лимфоцитов. Немаловажно, что для проведения исследований используются отечественные реагенты.
Метод доказал свою клиническую эффективность в диагностике ПИД и представлен в четырех инструкциях по применению, утвержденных Минздравом. В настоящее время применяется в РНПЦ ДОГИ для выявления врожденных нарушений иммунитета.

Неонатальный скрининг на выявление ПИД
Обоснование скрининга новорожденных вытекает из знаний о том, что ТКИН потенциально излечима, но не распознается эффективно до начала опасных для жизни ребенка инфекций.
Впервые в Беларуси в Минске с апреля этого года начинается совместный пилотный проект РНПЦ ДОГИ и комитета по здравоохранению Мингорисполкома по скринингу новорожденных на ПИД. Это позволит вовремя распознать врожденное нарушение иммунной системы и провести своевременное лечение. Пилотное скрининговое исследование будет проводиться в течение года, за этот период будет обследовано около 12 тысяч новорожденных.
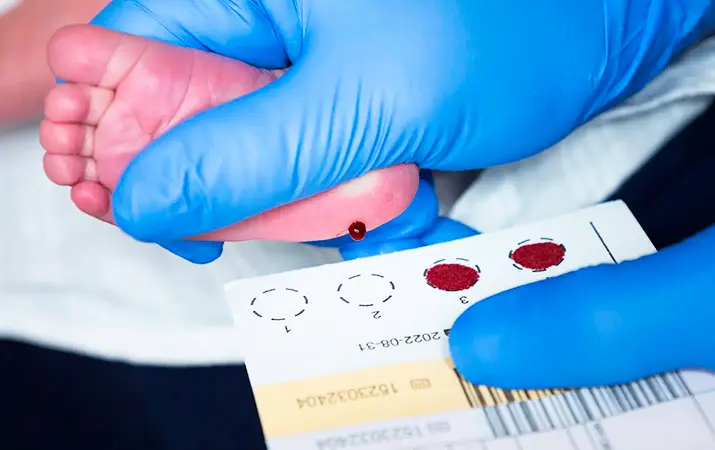
Что нужно для проведения исследования? всего одно пятно сухой капли крови, которая берется у новорожденного из пятки и наносится на фильтровальную бумагу.
Особенности определения TREС и KREC
Для скринингового исследования на ПИД будет использована мультиплексная ПЦР в режиме реального времени с одновременным исследованием сразу двух маркеров. Оптимальный срок выполнения данного исследования определяется маркером TREC, что обусловлено процессом онтогенеза иммунной системы с более поздним появлением Т-лимфоцитов в системе кровообращения плода. Поэтому важно учитывать гестационный возраст новорожденного и проводить исследование не ранее возраста, соответствующего 36–37 неделям гестации, так как именно с этого возраста показатели TREC и KREC не отличаются от таковых у доношенных новорожденных.
Когда есть подозрение на ТКИН или комбинированный иммунодефицит, который, как правило, является наиболее частым «сценарием» у недоношенных детей, первыми диагностическими шагами все же должен быть скрининг новорожденных с определением эксцизионных колец Т- и В-клеточных рецепторов (TREC/KREC).
Получение низких показателей относительно нижнего порога нормальных значений TREС и/или KREC — повод для иммунологического и молекулярно-генетического обследования.
Согласно мировым данным, средний возраст постановки диагноза ПИД при отсутствии скрининга колеблется в разных странах от одного дня до полутора лет, составляя в среднем 4 месяца. В семьях с отягощенным анамнезом по ПИД такие дети, как правило, выявляются раньше и начинают получать адекватное лечение в более раннем возрасте, до развития тяжелой инфекции, однако частота случаев семейной патологии составляет не более 20 % общего количества пациентов с ПИД. Именно поэтому проведение скрининга на выявление врожденных ошибок иммунитета позволит улучшить раннюю диагностику, что является залогом эффективного лечения.
Затраты на один анализ по определению TREC/KREC составляют ориентировочно 20 белорусских рублей. Выявление одного новорожденного с ПИД и проведение ТГСК в первое полугодие его жизни позволит сэкономить до 300 тысяч белорусских рублей в сравнении с затратами на лечение и пребывание ребенка в стационаре.
Ранняя диагностика, до того, как у младенца появятся какие-либо инфекции, чрезвычайно важна, поскольку ТГСК, проведенная в первые три с половиной месяца жизни, дает 94 % успеха до начала инфекции.
Клинические случаи
Девочка Е., родилась от 3-й беременности, 3-х срочных родов. Масса тела при рождении 4 080 г, рост 53 см. В возрасте 2,2 месяца появилась мелкоточечная геморрагическая сыпь на коже нижних конечностей и лице. Анамнез отягощен: смерть сестры в возрасте 6 месяцев. При патологоанатомическом исследовании: в тимусе отсутствие лимфоцитов и телец Гассаля, тяжелая пневмония, гепатит, полиорганные функциональные расстройства. Диагноз ТКИН установлен посмертно.
В возрасте 3 месяцев пациентка поступает в РНПЦ ДОГИ. Количество копий TREC — 0 копий/106 [2,2×106–4,5×105], KREC — 8,2×103 копий/106 [2,0×103–2,9×105]. ОАК: нейтрофилез со сдвигом влево, лейко- и лимфопения (лейкоциты 3,7×10⁹/л [5,5–13,0×10⁹/л], лимфоциты 1,4×10⁹/л [3,5–9,0×10⁹/л]). В иммунограмме снижено количество Т-лимфоцитов (СD3+ — 0,05×10⁹/л [0,6–2,2×10⁹/л]), повышено количество В-лимфоцитов (CD19+ — 0,92×10⁹/л [0,11–0,53×10⁹/л]), нормальное количество натуральных киллеров (CD3-CD16+CD56+ — 1,26×10⁹/л [0,1–1,9×10⁹/л]).
Результат УЗИ: печень выступает из-под реберной дуги +0,5–1 (см).
Учитывая семейный анамнез, данные TREС/KREC иммунологического исследования, девочке установлен диагноз ТКИН с иммунофенотипом T-B+NK+. Выполнена ТГСК. Посредством секвенирования следующего поколения (англ. Next-generation sequencing, NGS) была установлена генетическая причина ТКИН — вариант в гене альфа цепи ИЛ-7 (IL7Rα).
В данной ситуации установление генетического диагноза имеет положительное значение для семьи, поскольку знание о семейном случае ТКИН позволит вести следующую беременность мамы девочки E. с обязательным медико-генетическим консультированием и перинатальной диагностикой.
Девочка У., родилась от 2-й беременности, 2-х преждевременных родов с гестационным возрастом 32 недели. В возрасте 2 месяцев поступила в РНПЦ ДОГИ. Температура тела 38,0 °С. C-реактивный белок 0,79 мг/дл [менее 0,5 мг/дл]. В ОАК анемия (Hb 109 г/л [125–175 г/л], эритроциты 3,75×1012/л [3,8–5,6×1012/л]), лейко- и лимфопения (лейкоциты 4,23×109/л [6,5–14,0×109/л], лимфоциты 2,96×109/л [3,5–9,0×109/л]. Клинический анамнез: генерализованная ЦМВ-инфекция.
При проведении определения количества копий TREC и KREC данные маркеры в периферической крови не детектировались (TREC=0 копий, KREC=0 копий), исследование проведено дважды. При иммунологическом исследовании Т-лимфоциты в норме лимфоцитов (СD3+ — 2,85×109/л [0,6–2,2×109/л]), В-лимфоциты снижены (CD19+ — 0,003×109/л [0,11–0,53×109/л]), снижены натуральные киллеры (CD3+CD16+CD56+ — 1,5 % [5–25 %]), низкое относительное содержание тимических мигрантов (CD4+CD31+CD45RA+ — 1,8 % [49–85 %]).
Пациентке поставлен диагноз ТКИН (Т-В-NK-). Проведено молекулярно-генетическое исследование и выявлен компаунд из двух патогенных гетерозиготных мутаций в гене RAG1, приводящих к ТКИН. Девочке выполнена ТГСК в возрасте 7 месяцев.
Мальчик М., гестационный возраст при рождении 25–26 недель. Масса тела при рождении 980 г, рост 30 см. Рожден от 1-й беременности, 1-х преждевременных родов. Оценка по шкале Апгар 6/8 на первой минуте. С рождения находился на ИВЛ, состояние тяжелое. Новорожденный ребенок был обследован и находился под наблюдением на базе РНПЦ «Мать и дитя».
В ОАК при рождении отмечается лейкоцитоз (лейкоциты 71,6×109/л [10,0–30,0×109/л]) и относительная лимфопения (лимфоциты 13,6 % [24,0–40,0 %]). При клинико-лабораторном исследовании установлен диагноз: сепсис новорожденного, обусловленный анаэробными организмами. На базе РНПЦ ДОГИ пациенту при фактическом гестационном возрасте 26–27 недель было выполнено определение количества TREC и KREC и субпопуляционного состава лимфоцитов периферической крови. Отмечалось снижение копий TREС с нормальным количественным содержанием KREC (TREC — 1×103 копий/106 [2,2×103–4,5×105], KREC — 1,6×104 копий/106 [2,0×103–2,9×105] лейкоцитов периферической крови).
При иммунологическом обследовании выявлено снижение относительного содержания Т-лимфоцитов (СD3+ — 27,4 % [41,0–88,0 %], наивных Т-лимфоцитов (CD3+CD45RA+ — 50,2 % [61,0–93,0 %], количество В-лимфоцитов в норме (CD19+ — 34 % [4–37 %]). У младенца отмечался дисбаланс клеточного и гуморального звеньев иммунитета, что характерно для недоношенных новорожденных.
При достижении гестационного возраста 27–28 недель исследования повторили. Отмечалось еще большее снижение TREC, показатели KREС оставались в диапазоне нормальных значений (TREC — 0,3×103 копий/106, KREC — 1,2×104 копий/106 лейкоцитов). Все так же отмечалась Т-клеточная лимфопения (СD3+ — 33,4 %), наивные Т-лимфоциты (CD3+CD45RA+ — 21,4 %). Состояние ребенка продолжало оцениваться как тяжелое.
Относительно клинической картины сепсиса, низких наивных лимфоцитов и показателей TREC возникла настороженность относительно диагноза ТКИН. Новорожденный был проконсультирован врачом-иммунологом РНПЦ ДОГИ Юлией Жаранковой, продолжено дальнейшее наблюдение для исключения/установления диагноза ТКИН.
На 27-й день жизни, когда гестационный возраст новорожденного составлял 29–30 недель, было проведено повторное исследование ОАК, уровней TREC и KREC и субпопуляционного состава лимфоцитов. В ОАК все также лейкоцитоз (лейкоциты 36,6ґ109/л), количество TREC все еще снижено, KREC в норме (TREC — 0,9×103 копий/106, KREC — 5,4×103 копий/106 лейкоцитов периферической крови). Относительное содержание Т-лимфоцитов и наивных в норме (СD3+ — 67,0 %, CD3+CD45RA+ — 78,8 %). Состояние новорожденного тяжелое.
Когда гестационный возраст мальчика достиг 35 недель, повторное исследование TREC и KREC показало, что и TREC и KREC были в диапазоне нормальных значений (TREC — 2,2×104 копий/106, KREC — 2,1×104 копий/106 лейкоцитов периферической крови). По данным иммунологического исследования CD3+ T-лимфоциты и наивные лимфоциты были также в диапазоне нормальных значений.
На 47-й неделе клиническая картина сепсиса разрешилась. По данным ОАК (лейкоциты 6,0×109/л, лимфоциты 58 %), количество наивных лимфоцитов было в норме, показатели TREC и KREC также оставались в диапазоне нормальных значений.
Таким образом, наблюдаемая лимфопения могла быть обусловлена незрелостью ребенка и клиническим статусом. По причине физиологически нормальных по возрасту иммунологических показателей генетическое исследование не проводилось.
Недоношенные дети имеют незрелую иммунную систему (с точки зрения как врожденного, так и адаптивного иммунного ответа), что является одной из причин их восприимчивости к различным тяжелым бактериальным, грибковым и вирусным инфекциям.
Учитывая наличие физиологического иммунодефицита недоношенных и возможного ПИД, специалисты в отделениях интенсивной терапии, неонатологи должны иметь высокую настороженность относительно ПИД при рецидивирующих или непрекращающихся инфекциях и воспалениях.
Именно по причине незрелости иммунной системы недоношенных новорожденных с целью исключения ложноположительных результатов рекомендуется проводить скрининговое исследование с определением TREC и KREC у таких детей не ранее 36 недель гестационного возраста.