Вирусно-генетическая теория возникновения опухолей, предложенная еще в 1940-х годах вирусологом Львом Зильбером (см. «МВ» № 1 от 5 января 2023 г.), в последнее время получает многочисленные подтверждения. Сегодня известно, что около 15 % новообразований человека связаны с вирусами. И хотя вирусы не являются единственной и основной причиной рака, они играют большую роль в этиологии злокачественных заболеваний.
Столетние исследования
 В 1911 году Пейтон Раус показал, что некий вирус (названный в его честь вирусом саркомы Рауса, RSV) вызывает саркому у кур. Позже изучению подобных РНК-вирусов (ретровирусов) позвоночных уделялось огромное внимание, поскольку была надежда, что это поможет установить механизм возникновения рака у человека.
В 1911 году Пейтон Раус показал, что некий вирус (названный в его честь вирусом саркомы Рауса, RSV) вызывает саркому у кур. Позже изучению подобных РНК-вирусов (ретровирусов) позвоночных уделялось огромное внимание, поскольку была надежда, что это поможет установить механизм возникновения рака у человека.
 Фрэнсис Пейтон Раус — американский патолог, лауреат Нобелевской премии по физиологии и медицине 1966 года «за открытие онкогенных вирусов». Разделил премию с Чарлзом Хаггинсом, награжденным «за открытия, касающиеся гормонального лечения рака предстательной железы».
Фрэнсис Пейтон Раус — американский патолог, лауреат Нобелевской премии по физиологии и медицине 1966 года «за открытие онкогенных вирусов». Разделил премию с Чарлзом Хаггинсом, награжденным «за открытия, касающиеся гормонального лечения рака предстательной железы».
Сейчас мы знаем, что геном многих онкогенных ретровирусов содержит сегменты, отличные от обычных вирусных генов. Эти сегменты представляют собой модифицированные клеточные гены, которые и обусловливают способность многих ретровирусов индуцировать образование опухолей. Они называются вирусными онкогенами (v-onc).
К середине 20-го века обнаружены вирусы, ассоциированные с опухолями у животных, в частности, открыты вирусы сарком и лейкозов мышей, кошек, обезьян, крупного рогатого скота. Позже было доказано, что практически у всех представителей животного мира имеются опухоли вирусного происхождения.
Основные положения теории Зильбера
Онкогенный вирус осуществляет наследственное превращение нормальной клетки в опухолевую из-за проникновения вирусного генома или его части в клетки животного. Два генома интегрируют (сливаются) между собой, придавая клетке совершенно новые свойства. Внедрившийся вирус (его геном) уже не играет роли в размножении трансформированных клеток, в образовании опухолей. Он, как правило, исчезает из крови и ткани, в которой была опухоль.
Опухоли, у которых вирусы идентифицированы в качестве этиологических факторов, обнаружены у многих видов млекопитающих и птиц. Они способны вызывать трансформацию клеток in vitro и индуцировать опухоли in vivo. В составе этих вирусов установлены либо специальные гены (онкогены), продукты которых непосредственно контролируют трансформированный фенотип зараженных клеток, либо гены, продукты которых индуцируют экспрессию других генов, участвующих в контроле пролиферации клеток.
Очень часто онкогенным вирусам приписывают свойства вирусов инфекционных. Причиной тому, видимо, являются достаточно хорошая информированность населения на бытовом уровне о вирусах, вызывающих инфекционные заболевания, и практически полная неосведомленность об онкогенных вирусах и их свойствах. И если внедрение инфекционного вируса в организм влечет за собой соответствующее заболевание, то, следуя логике обывателя, заражение онкогенным вирусом должно привести к возникновению соответствующей опухоли.
У многих представителей животного мира такая взаимосвязь, действительно, довольно часто наблюдается. Так, вирусы лейкоза кур, мышей, крупного рогатого скота вызывают соответствующие лейкозы; вирус папилломы кролика — папиллому у кроликов и т. д. Однако взаимоотношения между онкогенными вирусами и представителями животного мира гораздо сложнее и многообразнее.
Оказалось, что некоторые вирусы, считавшиеся онкогенными только для одного вида животных, способны вызывать опухоли у разных представителей млекопитающих (например, куриный вирус саркомы Рауса вызывает также опухоли у крыс, мышей, кроликов, змей и др.). В почках зеленой мартышки обнаружен вирус (SV-40), непатогенный для этого вида обезьян, но высокоонкогенный для некоторых видов млекопитающих, в частности хомяков.
Не менее сложной оказалась ситуация и с онкогенными вирусами человека: часть из них может персистировать в организме инфицированного всю жизнь, не вызывая новообразования и какой-либо другой патологии. Некоторые вирусы являются убиквитарными для человека (т. е. чрезвычайно широко распространены в популяции), благополучно с ним сосуществуя. После заражения онкогенным вирусом опухолевый процесс может возникнуть, но, вероятно, при сочетанном действии дополнительных факторов и наличии определенных условий.
Одно из чрезвычайно важных отличий инфекционного вируса от онкогенного заключается в том, что генетический материал опухолеродных вирусов, как правило, внедряется функционально и физически в геном клетки, нарушая ее нормальную жизнедеятельность и превращая в конечном итоге в злокачественную. При этом инфицированная клетка не гибнет, но усиленно размножается. Инфекционный же вирус, проникая в клетку, заставляет все ее ресурсы работать на себя, что крайне редко происходит с онкогенным вирусом. В этом случае процесс заканчивается созреванием вирусного потомства и гибелью клетки.
Другое важное отличие онкогенных и инфекционных вирусов состоит в том, что в геноме большинства ДНК- и РНК-содержащих онкогенных вирусов есть гены, которые кодируют белок, ответственный за превращение нормальной клетки в опухолевую. Причем попадание в организм животного вируса, содержащего онкоген (примером могут служить саркоматозные вирусы птиц и других животных), приводит к быстрому возникновению опухоли. У животного, зараженного вирусом, не содержащим онкогена (примером могут служить лейкозные вирусы мышей), латентный период возникновения новообразования может занять большую часть их жизни.
Следует отличать опухоли, индуцированные вирусами, от опухолей, в которых вирус присутствует в качестве «пассажира».
При вирусном происхождении опухоли заражение клеток предшествует ее появлению, и вирусные маркеры в организме возникают еще до формирования опухоли. В опухоли невирусного происхождения клетки могут быть заражены вирусом уже после ее появления.
Опухоль вирусного происхождения возникает из одной-единственной зараженной вирусом клетки. Для такой опухоли характерны моноклональность и интеграция вируса в одни и те же места генома опухолевой клетки. Обнаружена также корреляция между высокой заболеваемостью определенным типом рака и высокой инфицированностью населения определенным типом вируса. Для опухолей, индуцированных вирусом, характерно снижение заболеваемости определенным типом рака после вакцинации против соответствующего вируса и/или проведения других профилактических мер.
Исследования 1970–1980-х гг. показали, что онкогены РНК-содержащих вирусов (ретровирусов), а также некоторых ДНК-содержащих онкогенных вирусов имеют клеточное происхождение. Было доказано, что когда-то много лет назад регуляторные гены клетки были захвачены этими вирусами и уже в составе вирусного генома превратились в онкогены.
Открытие оказалось чрезвычайно важным для понимания механизма возникновения опухоли, т. к. стала очевидной возможность превращения нормальных клеточных генов в онкогены под воздействием спонтанных или вызванных какими-либо факторами генетических мутаций и без участия вирусов. И действительно, такие клеточные онкогены, не имеющие никакого родства с вирусными онкогенами, были обнаружены во многих опухолях невирусного происхождения человека и животных.
Не менее важным для понимания механизмов канцерогенеза оказалось и открытие в нормальной клетке генов-супрессоров (например, р53 или Rb), препятствующих превращению клетки в злокачественную. Инактивация генов-супрессоров и преобразование регуляторных клеточных генов в активно функционирующий онкоген представляется сегодня основным механизмом превращения нормальной клетки в опухолевую. Опухоли же, индуцированные вирусами, представляют собой лишь частный случай внесения онкогенов извне в клетку и инактивации в ней генов-супрессоров. Иначе говоря, вирус, наряду с химическими канцерогенами и лучевой энергией, следует рассматривать в качестве одного из возможных канцерогенных факторов, способных индуцировать опухоль.
Механизмы клеточной трансформации
Чтобы стать злокачественной, клетка должна приобрести по крайней мере 6 свойств — результат мутации генов, ответственных за деление, апоптоз, репарацию ДНК, внутриклеточные контакты и т. д.
На пути к злокачественности клетка, как правило:
- самодостаточна в плане сигналов пролиферации (что может быть достигнуто активацией некоторых онкогенов, например Н-Ras);
- нечувствительна к сигналам, подавляющим ее рост (что происходит при инактивации гена опухолевого супрессора Rb);
- способна ослабить или избежать апоптоза (что происходит в результате активации генов, кодирующих факторы роста);
- формирование опухоли сопровождается усиленным ангиогенезом (что может быть обеспечено активацией гена VEGF, кодирующего ростовые факторы эндотелия сосудов);
- генетически нестабильна;
- не подвергается клеточной дифференцировке;
- не подвергается старению;
- характеризуется изменением морфологии и локомоции, что сопровождается приобретением свойств к инвазии и метастазированию.
Поскольку мутации генов являются событиями случайными и достаточно редкими, их накопление для инициации клеточной трансформации может длиться десятилетиями. Трансформация клетки может произойти гораздо быстрее в случае высокой мутагенной нагрузки и/или дефектности (слабости) механизмов защиты генома (генов p53, Rb, репарации ДНК и некоторых других).
Комплексный анализ генома выявил драйверные гены, в том числе APC, KRAS, TGFBR2 и TP53, мутации которых часто фиксируются при колоректальном раке (например, мутация p53 обнаруживается примерно в 60 % случаев, и большинство мутаций относится к миссенс-типу в «горячих точках», что предполагает онкогенную роль мутантного p53 посредством механизмов «приобретения функции»). В случае же инфицирования клетки онкогенными вирусами кодируемые вирусным геномом белки, обладающие трансформирующим потенциалом, нарушают нормальные клеточные сигнальные связи, обеспечивая условия для активной клеточной пролиферации.
Характерной особенностью опухолевых заболеваний, ассоциированных с вирусами, является длительный латентный период. От момента инфицирования до проявления заболевания проходит от 10 до 40 лет.
Эксперты Международного агентства по изучению рака (МАИР) в качестве онкогенных для человека рассматривают: вирусы гепатита В и С, вызывающие рак печени; определенные типы (16 и 18) папилломавирусов человека, являющихся этиологическим агентом рака шейки матки и некоторых опухолей аногенитальной сферы; вирус Эпштейна — Барр, принимающий участие в возникновении целого ряда злокачественных новообразований; герпесвирус человека 8-го типа, играющий важную роль в возникновении саркомы Капоши, первичной выпотной лимфомы, болезни Кастельмана и некоторых других патологических состояний; вирус Т-клеточного лейкоза человека (HTLV-I), являющийся этиологическим агентом Т-клеточного лейкоза взрослых (у каждого 30-го из носителей HTLV-I развивается Т-клеточная лейкемия/лимфома; практически все матери пациентов с этим заболеванием являются носительницами HTLV-I), а также тропического спастического парапареза и ряда других неонкологических заболеваний; вирус иммунодефицита человека, не обладающий трансформирующими генами, но создающий необходимые условия (иммунодефицит) для возникновения рака.
Вирусы гепатита В и С относятся к числу вирусов непрямого действия, поскольку не содержат в своем составе онкогена. Онкогенный потенциал они проявляют путем активации клеточных генов, участвующих в процессах пролиферации.
Вирусный канцерогенез имеет ряд существенных особенностей, связанных с привнесением в клетку собственной генетической информации. В случае онкогенных ретровирусов можно утверждать, что они выступают либо в качестве агентов, активирующих клеточные протоонкогены (слабоонкогенные вирусы), либо несут трансформирующие последовательности, ведущие свое происхождение от тех же клеточных протоонкогенов. Причем имеющиеся мутационные различия в кодирующей последовательности вирусного онкогена и клеточного протоонкогена играют существенную роль в повышении его трансформирующей активности.
Что касается герпесвирусов, то их структура настолько сложна, что все имеющиеся экспериментальные данные об онкогенном потенциале отдельных участков генома этих вирусов пока носят предварительный характер. При этом выяснено, что герпесвирус ассоциирован с саркомой Капоши.
Механизм опухолевой конверсии под действием вирусов специфичен для каждого типа вируса, но, как правило, связан с нарушением функций клеточных генов, участвующих в процессах деления и пролиферации клеток. Это может быть прямая инактивация генов-супрессоров в результате взаимодействия с продуктами вирусных генов, как в случае вирусов папиллом, или результат трансактивирующего действия вирусных генов на клеточные гены, модулирующие пролиферацию клеток, как в случае вируса гепатита В.
Вирус может являться инициирующим фактором. Для полного проявления онкогенного потенциала вирусных генов необходимы дополнительные генетические изменения в геноме инфицированной клетки, приводящие к формированию моноклональной популяции клеток с неконтролируемой пролиферацией.
За последнее время произошел большой прогресс в изучении механизмов вирусного онкогенеза. К ключевым моментам можно отнести открытие мутационного эффекта вирусов и их онкогенов на геном млекопитающих, выявление инсерционного мутагенеза, вызываемого внедрением вирусов в геном, обнаружение влияния, оказываемого продуктами различных вирусных генов на экспрессию клеточных генов.
Вместе с тем накоплены данные, указывающие на то, что канцерогенез является многоэтапным процессом. Как правило, к злокачественному перерождению приводит каскад событий, затрагивающих множество различных клеточных и вирусных генов. При этом не всегда понятно, что служит основным сигналом, запускающим данный каскад.
Известно, что вирусы влияют на апоптоз клеток и этим пролонгируют или сокращают их выживание. В частности, показано, что вирус иммунодефицита человека индуцирует апоптоз в CD4+ T-лимфоцитов, вирус болезни Марека оказывает антиапоптотическое действие на Т-лимфоциты. При этом разные вирусы используют разные стратегии влияния на апоптоз клетки хозяина. Так, вирус простого герпеса в результате конвергентной эволюции приобрел белок, имеющий сходство с антиапоптотическими клеточными белками семейства Bcl-2. Становится очевидным, что влияние вирусов на апоптоз и, в частности, на его предотвращение может быть одним из механизмов вирусного канцерогенеза (см. рисунок).
Рисунок. Влияние вирусов на апоптоз.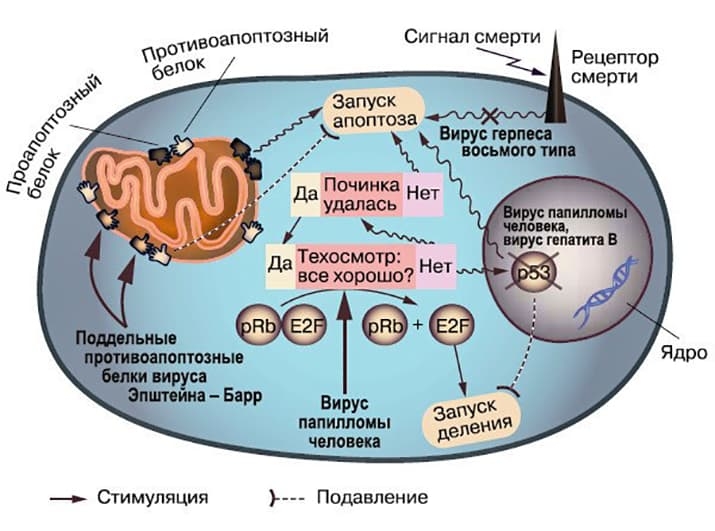
Мутационная теория рака основывается на положении, что все канцерогены являются одновременно мутагенами. Выяснилось, что даже те канцерогены, у которых ранее мутагенное действие не было обнаружено, приобретали его, попадая в организм, в результате активации. Мутагенными оказались не только различные химические вещества и физические факторы, но и «живые канцерогены» — онкогенные вирусы. Это было установлено для таких онкогенных ДНК-содержащих вирусов, как SV40 и некоторые аденовирусы.
Таким образом, вирусные онкогенные последовательности являются чужеродным генетическим материалом, не участвуют в процессах размножения вируса и, более того, в подавляющем большинстве случаев делают вирус дефектным по репликации за счет замещения онкогеном части необходимых вирусных генов.
Общие биологические свойства онкогенных вирусов
Несмотря на различную организацию онкогенных вирусов человека, неодинаковый спектр их клеток-мишеней, они обладают рядом доказанных общих биологических свойств, а именно:
- вирусы лишь инициируют патологический процесс, усиливая пролиферацию и генетическую нестабильность инфицированных ими клеток;
- у инфицированных онкогенными вирусами лиц возникновение опухоли, как правило, событие нечастое: один случай новообразования среди сотен, иногда тысяч инфицированных;
- после инфицирования до возникновения опухоли проходит продолжительный латентный период, длящийся годами, иногда десятилетиями;
- у большинства инфицированных лиц возникновение опухоли не является обязательным, но они могут составить группу риска с более высокой возможностью ее возникновения;
- для злокачественной трансформации инфицированных клеток необходимы дополнительные факторы и условия, приводящие к селекции наиболее агрессивного опухолевого клона.
Доказанные дополнительные факторы, играющие роль коканцерогенов:
- наличие в продуктах питания афлатоксинов, а также токсические дозы алкоголя для вирусов гепатита В и С;
- использование моющих средств, содержащих деготь;
- табакокурение;
- длительная экспозиция к дыму;
- вирус простого герпеса 2-го типа;
- вирус папилломы человека 16/18-генотип;
- малярия;
- нитрозамины в продуктах питания (соленая и вяленая рыба);
- пестициды;
- некоторые типы красок;
- недостаточное питание (дети, снижение иммунокомпeтентности);
- мази, содержащие форболовые эфиры (для вируса Эпштейна — Барр);
- иммуносупрессанты.
Остается много вопросов, связанных, например, с биологией взаимоотношений между онкогенным вирусом и инфицированным хозяином, спектром типов клеток, естественно инфицированных этими вирусами in vivo, защитными механизмами, позволяющими вирусу персистировать в организме, несмотря на иммунологическую защиту.
Возникновение вирус-ассоциированных опухолей человека после длительного латентного периода свидетельствует о том, что даже в «вирусных» опухолях нужно несколько генетических событий для полного проявления онкогенного потенциала вирусных генов. Эти вторичные генетические процессы и механизмы их действия практически не изучены. Механизмы канцерогенеза, ассоциированные с вирусом гепатита С, неясны из-за отсутствия адекватных клеточных моделей и являются предметом исследований.
Важной задачей остается и разработка вакцин и/или других средств иммунной интервенции против возможных вирус-ассоциированных опухолей.