Внедрение в хирургическую практику новых технологий, в частности предоперационного компьютерного 3D-моделирования, позволяет выполнять сложнейшие реконструктивные органосохраняющие операции, которые еще совсем недавно казались невозможными. Об этом в интервью «Медвестнику» рассказал ведущий научный сотрудник лаборатории торакальной онкопатологии РНПЦ онкологии и медицинской радиологии им Н. Н. Александрова, кандидат мед. наук Сергей Еськов.
Сергей Александрович, насколько важно применение органосохраняющих методик при операциях на легких и как давно такие вмешательства выполняются в нашей стране?
Методом выбора лечения пациентов с локализованным раком легкого является хирургический. Пневмонэктомия (удаление легкого) признана золотым стандартом объема операции при центральном раке легкого. К сожалению, данный объем операции сопровождается высоким риском послеоперационных осложнений и летального исхода.
Послеоперационная летальность достигает 12 %. Пятилетняя общая выживаемость пациентов после пневмонэктомии составляет всего 32 %. Часто качество жизни снижается из-за дефицита ткани легкого после удаления органа. Кроме того, при удалении легкого происходит резкое уменьшение просвета сосудистого русла малого круга кровообращения, что приводит к увеличению нагрузки на правые отделы сердца. Некоторые авторы именуют саму пневмонэктомию заболеванием, предрасполагающим к смерти от сердечно-легочной недостаточности.
В эпоху пандемий респираторных инфекций сохранение паренхимы легкого имеет особое значение. Поэтому основным трендом в торакальной онкохирургии последнего десятилетия стало широкое внедрение органосохраняющих реконструктивных оперативных вмешательств на легких как альтернативы пневмонэктомии в случаях, когда опухоль поражает бронх или артерию за пределами одной доли. Это позволяет избежать неблагоприятных последствий удаления целого легкого и инвалидизации пациента.
В нашей стране эти операции стали внедряться под руководством профессора Владимира Жаркова. В 2011 году выполнена первая аутотрансплантация легкого по поводу рака. А уже в 2015-м накопленный опыт позволил нам выполнить первую успешную билатеральную трансплантацию легких. За почти 20 лет накоплен колоссальный опыт, который насчитывает сотни сложнейших реконструктивных операций.
Сейчас продолжаете развивать реконструктивные методики?
Мы не стоим на месте. Пришли к пониманию, каким образом можно улучшить результаты хирургического лечения пациентов с опухолями легкого центральной локализации. Сделать это можно за счет повышения доли пациентов, которым выполняем органосохраняющие реконструктивные вмешательства. Причем не просто выполняем, а делаем это радикально и безопасно. Если коротко, то это достигается за счет индивидуализации подхода к каждому пациенту путем применения предоперационного 3D-моделирования. Именно этому посвящено научное исследование, которым я в настоящее время занимаюсь под руководством академика Сергея Красного.
Какие преимущества у 3D-моделирования?
Дело в том, что до сих пор в мире не разработаны четкие критерии, по которым бы решался вопрос, в каком случае нужно удалить пораженное опухолью легкое, а в каком можно сохранить часть. Потому что все очень индивидуально — соотношение разных структур варьирует, сосуды и бронхи могут по-разному располагаться у разных людей, и, разумеется, размеры и локализация опухоли различны. Все это учесть, просто мысленно представив в голове, наверное, невозможно.
Предоперационное 3D-моделирование расширяет наши возможности. По данным компьютерной томографии строим 3D-модель, на которой разными цветами отмечены важные для нас структуры, виртуальной линеечкой с точностью до 1 мм отмеряем все расстояния. Учитываем, что при раке легкого нужно отступить не менее 15 мм в пределах здоровой ткани, отмеряем эти сантиметры. Далее смотрим, где должна пройти линия пересечения всех структур — бронха, артерии, вены, легкого — и делаем расчеты. Самое главное — не только пересечь на безопасном расстоянии, но и в том месте, где это все потом можно сшить, чтобы оставшаяся часть легкого могла функционировать. Все эти нюансы учитываются на 3D-модели (см. рис. 1).
Рисунок 1. Построение 3D-модели легкого и виртуальное планирование органосохраняющей операции.
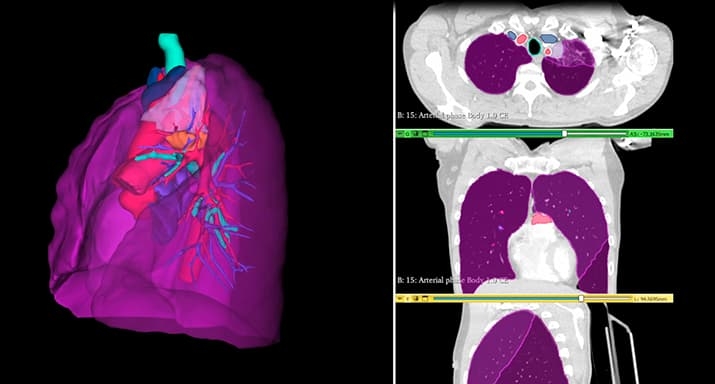
Это позволяет объективизировать выбор объема операции, причем сделать это накануне.
Это пациенты с первичным раком легкого?
И при первичных опухолях в легком, и при метастазах выполняем такие вмешательства. В любом случае реконструктивная операция увеличивает шансы жить. Простой пример. Если по поводу первичной опухоли удалено легкое, а через какое-то время опухолевый процесс развивается во втором легком, то помочь может только трансплантация донорского органа, что проблематично у пациента с онкологическим заболеванием.
Если же у этого пациента во время удаления первично выявленной опухоли сохранили часть одного легкого, а спустя какое-то время во втором легком появились новые опухолевые очаги, то остается возможность выполнения еще одной операции, если возникнет такая необходимость. К слову, в торакальной онкологии развитие первично-множественных опухолей в легких — довольно частое явление. Очень часто пациенты обращаются к нам с опухолями в обоих легких. В этом случае реконструктивная операция — единственный вариант радикального лечения.
Сергей Александрович, 3D-моделирование и сложные реконструктивные вмешательства на легких выполняются только в РНПЦ ОМР? Если пациенту по месту жительства выставлен диагноз «рак легкого», предстоит операция, он может попасть в ваш центр?
Мы готовы помогать пациентам со всей страны. Поэтому сейчас активизировали контакты с коллегами из регионов, в т. ч. в рамках телемедицинского консультирования. Если появляется пациент, у которого вместо удаления легкого возможно выполнение сложного реконструктивного вмешательства, просим прислать запись КТ.
Далее строим 3D-модель, по результатам которой понимаем, возможна ли в принципе органосохраняющая операция или же придется удалять легкое целиком. Если вмешательство возможно, то пациента направляют в наш центр. Нашли и альтернативный вариант, который в марте прошлого года успешно апробировали в Гродненской университетской клинике. По одному из пациентов приняли решение выполнить операцию на их базе совместной бригадой. К слову, они хорошо оснащены самым современным оборудованием, коллеги торакальные хирурги и анестезиологи-реаниматологи — профессионалы высокого уровня.
В чем особенности этого клинического случая?
Опухоль у пациента локализовалась в верхней доле левого легкого, не успев поразить его полностью. Диагноз заподозрили по результатам КТ, выполненной по поводу коронавирусной инфекции. В торакальном отделении ГрУК пациента дообследовали. Онкологический диагноз подтвердился, опухолевый процесс затрагивал верхнюю долю легкого с поражением бронха и врастанием в легочную артерию. Согласно стандартному подходу пациенту удалили бы легкое целиком.
По результатам 3D-моделирования мы спланировали и выполнили органосохраняющую операцию (за операционным столом более 4 часов вместе с Сергеем Еськовым работали торакальный хирург Юрий Кропа, анестезиолог-реаниматолог Екатерина Будейко, заведующий отделением анестезиологии и реанимации Александр Балла. — Прим. ред.). Пораженные опухолью участки легкого, бронха, артерии удалили, а здоровые части сшили в соответствии с виртуальным планом так, что частично сохраненный орган продолжил нормально функционировать. Пациент приезжал на контрольное обследование. И что удивительно: показатели функции внешнего дыхания у него стали даже лучше, чем до операции, мы такого даже не ожидали.
Бывают ли незапланированные сюрпризы в процессе подобных вмешательств? Например, на 3D-модели что-то не заметили, а увидели только в ходе операции?
Наоборот, 3D-моделирование значительно снижает подобные сюрпризы, таким образом повышается безопасность оперативного вмешательства. Большое преимущество в том, что мы можем выявлять различные анатомические варианты. Например, у одного пациента на предоперационной 3D-модели мы заметили довольно крупный венозный сосуд, идущий от здорового правого легкого в том месте, где в норме его быть не должно. Если бы мы не знали об этом, то во время операции на левом легком при выполнении лимфодиссекции, скорее всего, повредили бы его.
Это привело бы к нарушению функции противоположного легкого, пациент бы не выжил. 3D-модель позволяет интуитивно воспринимать сложную трехмерную картину, которая не так очевидна при просмотре двухмерных сканов. Среди пациентов, которым мы строили 3D-модели, у 10 % выявили различные сосудистые аномалии, о которых важно было знать до операции.
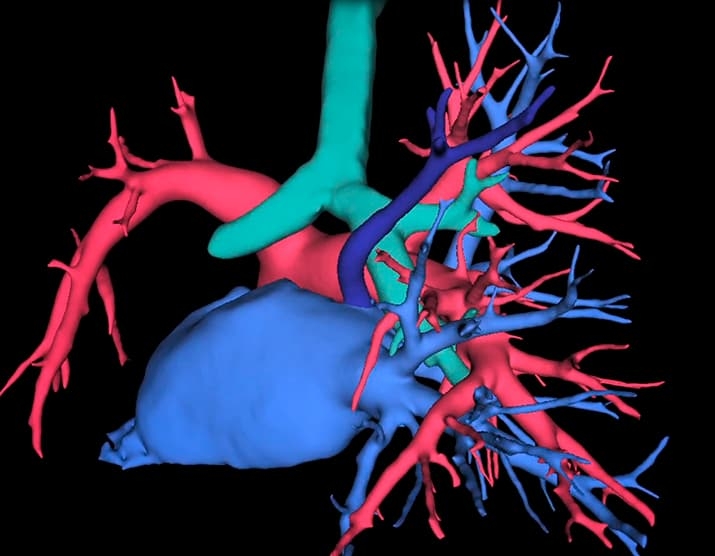
При виртуальном планировании мы можем смоделировать положение разных структур относительно друг друга и в одних случаях спрогнозировать натяжение, которое ляжет на анастомозы, в других заранее определить избыток длины артерии, которая из-за этого перегнется. Благодаря этому мы можем запланировать применение приемов, которые позволят этого избежать (см. рис. 2).
Рисунок 2. 3D-модель бронхов и сосудов легкого помогает интуитивно понять их пространственное взаимоотношение. Темно-синим цветом выделен аномально расположенный сосуд — предоперационное моделирование помогает избежать его повреждения во время операции.
Как часто выполняете такие сложные вмешательства?
За год с небольшим уже более 40, это взрослые пациенты со злокачественными новообразованиями в легких.
Сергей Александрович, вы оперируете и детей в тандеме с коллегами из РНПЦ детской хирургии. В частности, в прошлом году благодаря предоперационному 3D-моделированию впервые в Беларуси торакоскопическим способом прооперировали ребенка с двойной дугой аорты. Применяется ли 3D-моделирование при операциях на легких у детей?
Да, применяется, но в отличие от взрослых, которых оперируем в основном по поводу злокачественных опухолей, у детей реконструктивные операции на легких связаны, как правило, с врожденными пороками развития. Это аномалии, не дающие органу, да и нередко организму в целом нормально функционировать. Благодаря применению 3D-моделирования в подавляющем большинстве случаев нам удается сделать операцию торакоскопическим способом — через сантиметровые разрезы (см. рис. 3, 4).
Рисунок 3. 3D-модель важнейших структур четырехлетнего пациента с врожденным пороком развития обоих легких. Благодаря 3D-планированию операции на правом и левом легком выполнены во время одного наркоза через сантиметровые разрезы. Пациент был дома на 5-й день после операции.
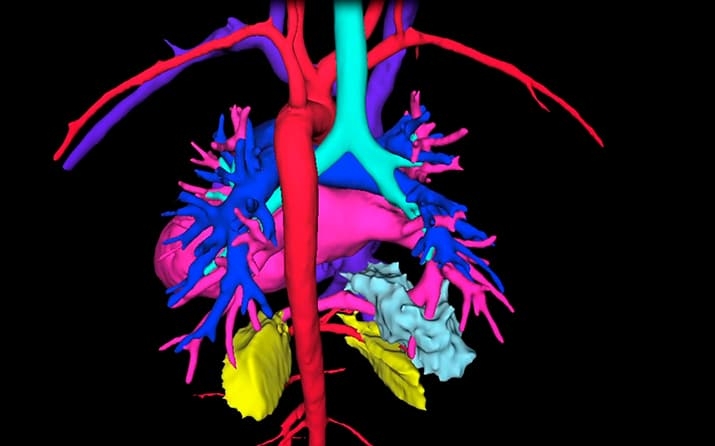
Рисунок 4. 3D-модель сосудов трехлетнего пациента. Операция выполнена через сантиметровые разрезы. Выписан на 5-й день после операции.
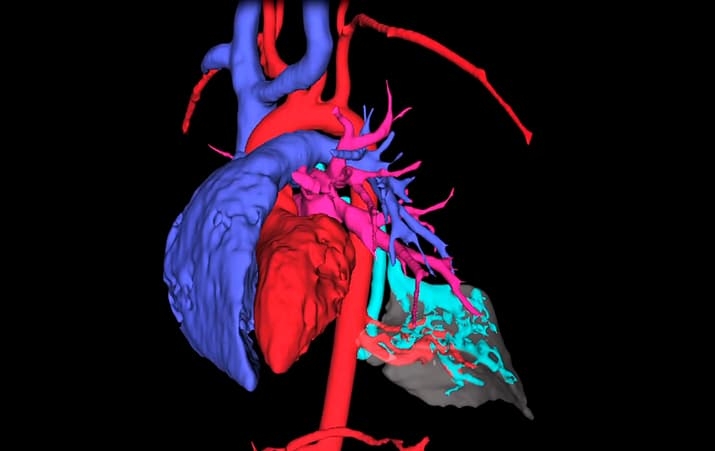
На 3D-модели очень хорошо видны пораженные участки легкого, которые нужно удалить. Линию его пересечения мы прокладываем на виртуальной модели с учетом расположения сосудов и бронхов в толще легкого. Благодаря этому соблюдаем баланс между полнотой резекции легкого и сохранением максимального объема его здоровой ткани.
3D-модель позволяет разобраться в хитросплетениях аномально расположенных сосудов и оптимально спланировать последовательность этапов операции. Это сокращает время вмешательства и снижает частоту осложнений. Немаловажным также является правильное планирование точек доступа в плевральную полость. Для каждой линии пересечения ткани легкого можно рассчитать оптимальную линию проведения аппарата, с помощью которого ткань легкого рассекается и прошивается. Виртуальное планирование позволяет минимизировать число и размеры разрезов для проведения инструментов.
Каким видите дальнейшее развитие этой перспективной технологии?
Когда я начал этим заниматься, в научных медицинских изданиях было совсем немного публикаций по предоперационному 3D-планированию при реконструктивных операциях по поводу рака легкого. Сейчас, спустя год, публикаций на эту тему по-прежнему очень мало. Но я думаю, что уже через несколько лет эта технология станет рутинной. Я абсолютно уверен, что в будущем все реконструктивные операции на легких будут планироваться только через 3D-моделирование. Сегодня в нашем центре мы делаем все для этого.
Есть планы внедрить в процесс 3D-моделирования элементы искусственного интеллекта, что позволит автоматически распознавать на КТ все структуры, которые нас интересуют, — бронхи, артерии, вены, опухоль. Специалист будет только контролировать правильность построения модели компьютером, а затем расставлять метки, где нужно отсечь. План операции будет готовиться в автоматическом режиме. Таким образом сможем обрабатывать огромное количество данных, вплоть до всех пациентов, которым планируется удаление легкого, в масштабах республики. По результатам будем отбирать пациентов для очень сложных реконструкций на базе РНПЦ ОМР им. Н. Н. Александрова. На сегодняшний день в
Беларуси выполняется 250 удалений легкого в год, 250 человек становятся инвалидами. мы считаем, что сможем уменьшить это количество как минимум вдвое, сохранив людям трудоспособность и качество жизни.
Досье
Сергей Еськов в 2002 году окончил лечебный факультет БГМУ, до 2005-го работал врачом-хирургом-онкологом Бобруйского межрайонного онкологического диспансера. В 2005–2012 годах — врач-хирург-онколог, научный сотрудник отдела торакальной онкопатологии с группой анестезиологии РНПЦ онкологии и медрадиологии им. Н. Н. Александрова. Является учеником известного торакального хирурга, доктора мед. наук, профессора Владимира Жаркова, основателя современной школы торакальной хирургии в Беларуси.
Участвовал во внедрении технологии хирургического лечения местно-распространенного рака легкого с инвазией в структуры и органы средостения, органосохраняющих ангио- и бронхопластических операций при опухолях легкого. В 2011 году выполнил первую в Беларуси аутотрансплантацию легкого.
С 2012-го по 2019 год заведовал торакальным отделением МНПЦ хирургии, трансплантологии и гематологии. Участвовал во внедрении технологии трансплантации легких в Беларуси. В 2015 году впервые в стране выполнил первую успешную билатеральную трансплантацию легких.
В 2018 году защитил кандидатскую диссертацию «Хирургическое лечение пациентов с местно-распространенным немелкоклеточным раком легкого с инвазией в органы и структуры средостения». C ноября 2019 года — ведущий научный сотрудник лаборатории торакальной онкопатологии РНПЦ ОМР им. Н. Н. Александрова. Автор более 80 печатных работ, имеет 8 патентов на изобретения.