Развитие основных методов — хирургического удаления опухоли, химиотерапии и лучевой терапии — определяет успех в лечении ряда онкологических заболеваний, но значительная часть онкологии остается проблемой, требующей новых подходов. Одним из перспективных направлений, за последние два десятилетия все больше проникающих в онкологическую клинику, является иммунотерапия рака. Внедрению в практику новых методов лечения предшествовало бурное развитие относительно новой фундаментальной науки — онкоиммунологии (cancer immunology).
История направления
 Новое направление начиналось со стихийных клинических экспериментов. Еще в 19-м веке два немецких врача Вильгельм Буш и Фридрих Фелейзен независимо друг от друга заметили регресс опухолей у онкологических больных после случайного заражения рожей и определили Streptococcus pyogenes как возбудителя рожи.
Новое направление начиналось со стихийных клинических экспериментов. Еще в 19-м веке два немецких врача Вильгельм Буш и Фридрих Фелейзен независимо друг от друга заметили регресс опухолей у онкологических больных после случайного заражения рожей и определили Streptococcus pyogenes как возбудителя рожи.
В 1891 году американский хирург Уильям Коли начал длительное исследование, выполняя инъекции термоинактивированных бактерий (токсинов Коли) пациентам с неоперабельным раком и наблюдая развитие болезни. Было пролечено более 1000 пациентов, главным образом с саркомами, и обнаружен хороший ответ вплоть до регрессии опухоли у части из них.
Неспособность удовлетворить требования «хорошей медицинской практики», этические проблемы и другие требования созданных в начале 20-го века регуляторных агентств ограничили применение токсинов Коли, а появление химиотерапии и лучевой терапии окончательно вытеснило их из клиники.
Как в предшествующий период, так и в настоящее время многие онкологи были и остаются весьма скептично настроенными в отношении иммунотерапии. Даже Фрэнк Бернет, автор теории «иммунного надзора» над опухолью, опубликованной в 1967 году, предсказавший вероятность иммунотерапии рака, не был уверен в возможности ее клинического использования («There is little ground for optimism about cancer»).
Действительно, свидетельства активной иммунной защиты от сформированной опухоли исключительно редки. С другой стороны, разрушительную силу иммунной системы хорошо демонстрирует трансплантология: быстрое отторжение аллогенного трансплантата обусловлено исключительно иммунными механизмами.
Постепенное накопление экспериментальных данных, развитие иммунологии доказывает теорию «иммунного надзора», а также объясняет неудачу иммунологической защиты при формировании опухоли и открывает огромные возможности для медицины.
В настоящее время иммунотерапия проходит период становления: известно множество провалов и неудач, есть несколько успешных и даже сенсационных примеров, но большая часть технологий все еще находится на уровнях доклинических и клинических испытаний.
Мы рассмотрим основные типы иммунотерапии, которые используются в клинике в настоящее время.
Пассивная иммунотерапия моноклональными антителами
Препараты моноклональных (таргетных) антител первыми были зарегистрированы для клинического применения и наиболее широко вошли в стандарты лечения, поэтому наиболее часто под иммунотерапией рака понимают именно их. С точки зрения иммунолога, антитела относятся скорее к таргетной терапии, чем к истинной иммунотерапии.
В 1997 году FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США) утвердило первый препарат — ритуксимаб (мабтера, ритуксан) для лечения В-клеточных лейкозов и лимфом, что стало существенным прорывом в онкологии. Сейчас зарегистрировано более сотни антител. В Беларуси, например, для лечения карцином применяются трастузумаб, пертузумаб, цетуксимаб и ряд других.
Производство антител было расширено на их производные, иммунотоксины, включающие токсичное вещество или радиоактивный изотоп, присоединенные к антителу, для их адресного накопления в опухоли, например, брентуксимаб ведотин — антитело к CD30, соединенное с токсином MMAE. В целом подход таргетов приближается к пределу своей эффективности, ограниченной рядом недостатков.
Антитела — ингибиторы иммунологического чекпоинта
Иммунологические контрольные точки (ИКТ, англ. Immunological checkpoints) — общее название рецепторов лимфоцитов, подавляющих иммунный ответ на его поздней стадии, т. е. выполняющих нормальные регуляторные функции. Повышение экспрессии ИКТ на лимфоцитах ведет к «фенотипу истощения», анергии и гибели клеток от апоптоза. Известен ряд таких рецепторов: CTLA-4, PD-1, TIM-3, LAG-3, TIGIT, B7/H3 и другие.
Оказалось, что моноклональные антитела, блокирующие эти рецепторы или их лиганды, снимают ингибирование и могут активировать незаметный прежде противоопухолевый иммунный ответ. За это открытие ученые Джеймс Эллисон из США и Тасуку Хондзе из Японии получили в 2018 году Нобелевскую премию. Из первых зарегистрированных антител этого ряда — ипилимумаб, блокатор CTLA-4, пембролизумаб и ниволумаб — ингибиторы PD-1.
Блокаторы других рецепторов находятся на этапах испытаний и регистрации. Они показали неожиданно хороший результат в лечении ряда злокачественных опухолей, например, ниволумаб выводит в ремиссию 87 % пациентов с лимфомой Ходжкина.
Для других опухолей процент клинического ответа ниже, но позволяет достичь успеха с рядом химиорезистентных опухолей. Это связано с тем, что такие лекарства не поражают и вообще не связывают опухоль, а снимают блокаду с противоопухолевого иммунитета в том случае, когда он есть — такие опухоли называют «горячие». «Холодные» опухоли требуют дополнительной иммунотерапии до использования ИКТ.
Противоопухолевые вакцины
Об этом виде иммунотерапии уже была наша публикация в «МВ» (№ 12 от 25 марта) — статья «Вакцинотерапия химиорезистентных опухолей». Это самый разнообразный подход, включающий множество вариантов по составу вакцины и способу введения. Первой и единственной на сегодняшний день истинной противоопухолевой вакциной является Sipuleucel-T против рака простаты, утвержденная FDA в 2010 году.
Несколько сотен вакцин находятся на разных стадиях клинических испытаний. Общей особенностью вакцин является их высокий профилактический (в данном случае — противорецидивный) потенциал и относительно низкий терапевтический, хотя стали известны способы их усиления, в том числе путем комбинации с другими видами иммунотерапии.
Клеточная иммунотерапия
Один из первых подходов иммунотерапии, который приобрел новые перспективы в связи с развитием технологий. Сюда можно отнести и ex vivo вакцины на основе дендритных клеток, но чаще всего подразумевается терапия с использованием натуральных киллерных клеток (NK) и лимфоцитов, обладающих прямой противоопухолевой активностью.
Один из подходов клеточной терапии — инфузия ex vivo экспансированных NK-клеток — в течение нескольких лет развивается в РНПЦ детской онкологии, гематологии и иммунологии.
Наибольшей сложностью метода являются особые условия культивирования NK-клеток — пациента вместе со специальной линией фидерных клеток, обеспечивающих многократный прирост и сильную активацию NK-клеток, достаточную для эффективной терапевтической дозы. Данный подход хорошо применим и используется для лечения миелоидного лейкоза, позволяет достигать клинического ответа без высокой токсичности.
Клеточные и молекулярно-биологические механизмы иммунотерапии рака.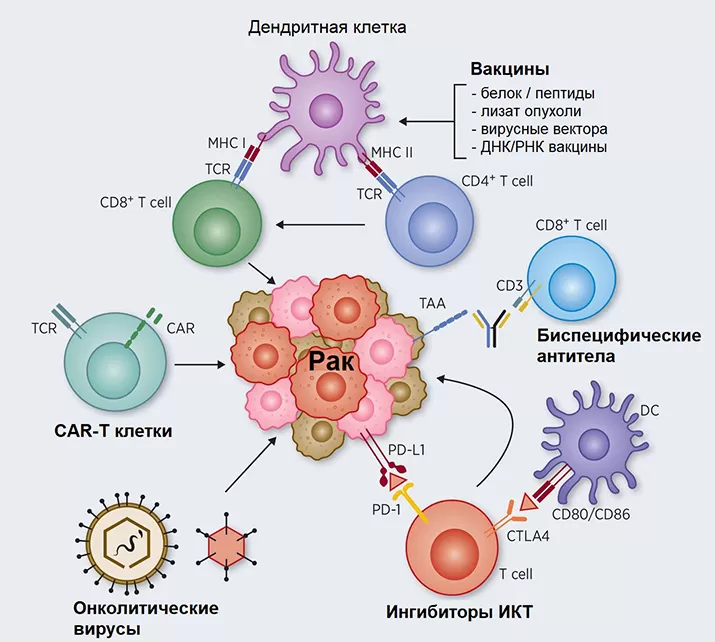
CAR-T-терапия
Самым перспективным вариантом клеточной терапии является получение лимфоцитов, генетически модифицированных для приобретения ими химерного антигенного рецептора, распознающего мишень на поверхности опухолевых клеток, — так называемая CAR-T-терапия. Это самая сенсационная иммунотерапия рака: первые испытания показали вплоть до 90 % ответа у пациента с рецидивом рефрактерного лимфобластного лейкоза, причем половина пациентов полностью излечивается от этого неизлечимого иначе заболевания.
Первый аутологичный клеточный продукт был зарегистрирован в США в 2017 году, на сегодня их уже 5, из которых 4 таргетируют CD19 для лечения В-клеточных лейкозов и лимфом, и один таргетирует другой В-клеточный антиген BCMA для лечения множественной миеломы. Сотни вариантов CAR-T-терапии множества онкологических заболеваний проходят клинические испытания.
С 2020 года в РНПЦ детской онкологии, гематологии и иммунологии после долгой подготовки начата успешная CAR-T-терапия клеточным продуктом собственного производства CD19+ лейкозов, что было описано в «МВ» (№ 5 от 4 февраля) — статья «Клиническая апробация нового метода CAR-T терапии острого лимфобластного лейкоза».
Таким образом, основной успех CAR-T-терапии достигнут в онкогематологии, но не в лечении солидных опухолей. Здесь метод встречает ряд ограничений, связанных с повреждением лимфоцитов пациента проводимой химиотерапией, ограниченным хоумингом лимфоцитов в опухоль и иммуносупрессивным микроокружением опухоли, что требует модификации метода.
В настоящее время большой коллектив ученых из РНПЦ ДОГИ, РНПЦ ОМР им. Н. Н. Александрова совместно с институтами биоорганической химии и физиологии НАН Беларуси работает над CAR-T-терапией нового поколения для лечения солидных опухолей.
Онколитические вирусы и бактерии
Подход, ведущий начало от токсинов Коли, продолжает развитие на более научной основе. Терапевтическое действие микроорганизмов может состоять в прямом уничтожении опухолевых клеток, но также включает адъювантный, вакциноподобный эффект, связанный с активацией противоопухолевого иммунитета. Именно так действует один из самых успешных вирусных препаратов T-VEC на основе вируса герпеса против меланомы, зарегистрированный FDA в 2015 году. Отечественных разработок в этом направлении пока не ведется.
Адъювантная иммунотерапия
Расширяется спектр методов, направленных на преодоление опухоль-опосредованной иммуносупрессии, помимо антител ингибиторов ИКТ. Сюда относят использование цитокинов и иммуномодуляторов. В том числе агонисты Toll-like receptor (TLR), вещества, сильно стимулирующие локальный и системный воспалительный и иммунный ответ.
Из множества кандидатов три зарегистрированы FDA для лечения рака: BCG (аттенуированный штамм микобактерий), известный также как вакцина от туберкулеза, monophosphoryl lipid A (MPL) и имиквимод. Такие адъюванты обычно применяют локально путем нанесения на поверхность кожи, введения внутрь опухоли или внутрь пузыря, как BCG для лечения рака мочевого пузыря и т. д. На стадии клинических испытаний находится линейка препаратов другого класса — ингибиторов IDO, фермента, подавляющего иммунный ответ в опухоли.
Развитие этого направления идет и в РНПЦ ДОГИ, в рамках фундаментальных исследований, в перспективе для лечения неоперабельных сарком, путем введения внутрь опухоли ДНК вакцины, индукторов интерферона и интерлейкина-12.
При обобщении результатов многочисленных клинических испытаний вырисовывается картина комплексной иммунотерапии онкологических заболеваний включающей разные методы, рационально совмещенные с таргетной и лучевой терапией.