Полноценное исследование периферической крови (гемограмма, или общий анализ крови) невозможно без изучения мазка крови, подсчета лейкоцитарной формулы, фиксации дегенеративных изменений, морфологических особенностей клеток и грамотной интерпретации результатов. Исследование мазка крови является своеобразным параллельным контролем данных гематологического анализатора.
В 2015 году группой экспертов Международного комитета по стандартизации в гематологии (ICSH) опубликованы рекомендации для описания морфологии клеток крови при исследовании окрашенных мазков: эритроцитов, лейкоцитов, тромбоцитов. В рекомендациях подчеркивается, что для полного диагностического исследования гемограммы на гематологическом анализаторе при появлении «флагов или сигналов тревоги» сохраняется необходимость микроскопического исследования окрашенных мазков.
Анализ представленного ICSH материала показал, что большинство предложенных рекомендаций соответствует устоявшимся правилам исследования и регистрации значимых для диагностики морфологических изменений клеток крови при исследовании окрашенных мазков. Вместе с тем исключительно важным является предложение четких терминов для обозначения активированных лимфоидных клеток при развитии иммунных реакций, таких как «реактивные лимфоциты» и «атипичные лимфоциты» при опухолях лимфоидной системы.
Система защиты соматической индивидуальности
Защита от всего генетически чужого (бактерии, вирусы, чужие клетки, белки) обеспечивается функциями врожденного и приобретенного иммунитета.
Врожденный, или неспецифический, иммунитет представлен защитными реакциями кожи, слизистых оболочек, клеток крови (нейтрофилов, эозинофилов, моноцитов, макрофагов, естественных киллеров), а также растворенных в жидкостях организма (секретах) бактерицидных факторов.
Приобретенный (адаптивный, специфический) иммунитет заключается в работе огромной армии морфологически неразличимых В- и Т-лимфоцитов по удалению из организма конкретного чужеродного агента (белка, вируса), с которым не справилась врожденная защита.
Как обеспечивается специфичность иммунного ответа
В эмбриогенезе при формировании лимфоидной системы образуется множество клонов лимфоидных клеток («высокоспециализированных отрядов»). На поверхности клеток каждого отдельного клона в результате генетических изменений формируются рецепторы к антигену только одной специфичности, т. е. лимфоциты одного «отряда» способны реагировать только на один чужеродный агент. Однако в целом «мозаика» из огромного числа вариантов клонов способна уничтожить большое количество разнообразных чужеродных молекул, которые могут попасть извне либо образоваться внутри организма человека.
Этот период развития лимфоидной системы называют доантигенной дифференцировкой лимфоцитов (наивные клетки). Они формируют запас защитных клеток на все случаи жизни, представляют собой временно «заторможенные» неделящиеся клетки, малые лимфоциты (стадия временного обратимого покоя, стадия G0). Они приспособлены к миграции по сосудам и тканям, контролируют чистоту внутренней среды организма. У новорожденного ребенка в крови преобладают готовые встретить «свой» антиген наивные клетки и убрать его из организма.
Малые лимфоциты (подобны циркулирующим стволовым клеткам) перемещаются в сосудистом русле и могут трансформироваться в бластные клетки, способные к делению. Благодаря этому увеличивается количество «бойцов спецотряда».
На этом процессе основано развитие первичного и вторичного иммунного ответа, в т. ч. после вакцинации.
Антигензависимая дифференцировка лимфоцитов (бласттрансформация, пролиферация, выполнение защитных функций) развивается только после появления в организме «своего для данного клона» специфического антигена. У новорожденного ребенка она начинается с первых дней жизни и продолжается до 2–3 и даже 5 лет, пока иммунная система знакомится с множеством чужеродных факторов окружающего мира. В этот период формируются клоны клеток памяти к различным антигенам (бактериальным, вирусным, чужим клеткам и др.). Повторное попадание антигена стимулирует более сильный, эффективный защитный ответ. На этом принципе основана вакцинация.
Постантигенный этап дифференцировки лимфоцитов включает следующие события:
- распознавание антигена Т- и В-лимфоцитами;
- трансформация их в делящиеся клетки;
- дифференцировка до зрелых эффекторных и регуляторных клеток;
- нейтрализация и уничтожение антигена;
- образование клеток памяти, имеющих мембранные рецепторы к соответствующему антигену.
Гуморальный и клеточный иммунитет
В-лимфоциты обеспечивают гуморальный иммунитет, т. к. после контакта с антигеном приобретают способность активно делиться (реакция бласттрансформации). Значительная часть превращается в плазматические клетки, которые секретируют антитела (иммуноглобулины), нейтрализующие чужеродные молекулы. Другая часть превращается в клетки памяти (по морфологии малые лимфоциты, резервные покоящиеся клетки) и обеспечивает повторный иммунный ответ на данный антиген, который заключается в выработке к нему антител.
Т-лимфоциты обеспечивают клеточный иммунитет, в котором принимают участие несколько разновидностей клеток. Антиген активирует пролиферацию Т-лимфоцитов и их дифференцировку в различные субпопуляции:
- Т-хелперы, активирующие иммунный ответ;
- цитотоксические клетки, разрушающие инфицированные бактериями и вирусами клетки, а также опухоли;
- Т-клетки, активирующие макрофаги и прочие клетки;
- Т-клетки памяти, обеспечивающие повторную защиту, и др.
От количества В- и Т-лимфоцитов и от того, насколько полноценны их функции, зависит защищенность человека от инфекций, появления злокачественных клеток, развития аллергии или аутоиммунного заболевания. Исследование количества различных видов лимфоидных клеток и их специфических функций проводят в специализированных иммунологических лабораториях.
Важный диагностический критерий
В клинико-диагностических лабораториях исследуются изменения общего количества лимфоцитов и их морфологии, что может быть важным признаком патологии в системе иммунитета.
Уменьшение или увеличение относительного количества (процентного содержания) лимфоцитов в лейкоцитарной формуле связано с изменением количества нейтрофилов в периферической крови. Важным критерием для диагностики является изменение абсолютного числа лимфоцитов в единице объема крови и его интерпретация.
Абсолютный лимфоцитоз можно наблюдать при следующих заболеваниях и состояниях:
- вирусные инфекции (инфекционный мононуклеоз (ИМ), ветряная оспа, корь, краснуха, паротит, полиомиелит, инфекционный лимфоцитоз, инфекционный гепатит, грипп, аденовирусные инфекции и др.);
- бактериальные инфекции (коклюш, туберкулез, сифилис, бруцеллез, болезнь кошачьей царапины и др.);
- инфекции любой этиологии у детей первых лет жизни;
- период выздоровления от острых инфекций;
- аллергические реакции;
- после вакцинации;
- гипертиреоидизм;
- хронический лимфолейкоз;
- лейкемизация лимфом.
Абсолютная лимфоцитопения развивается при вторичных и врожденных иммунодефицитных состояниях.
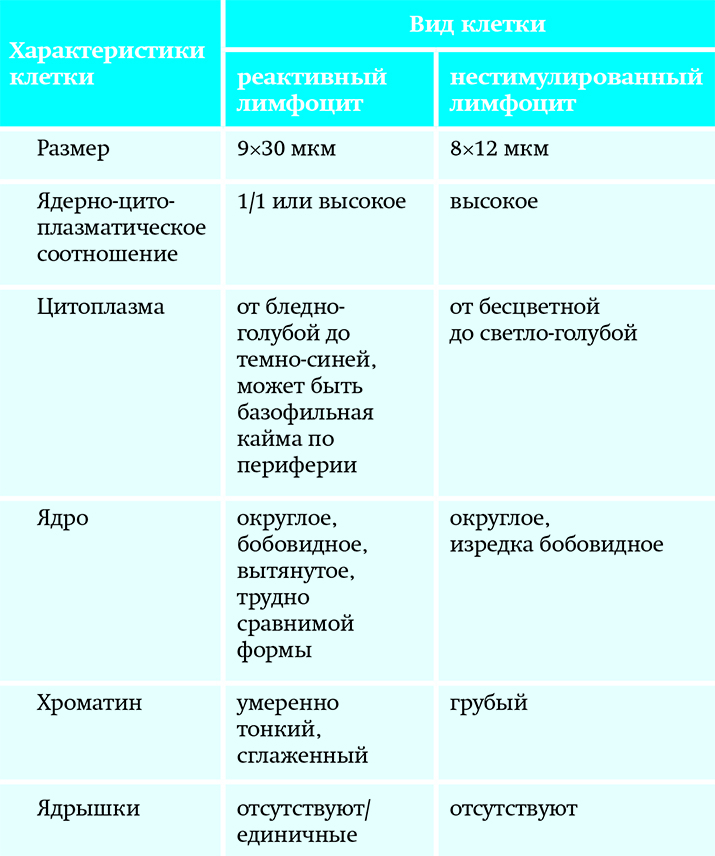
Морфологические отличия реактивных и нестимулированных лимфоцитов
У здорового человека большая часть циркулирующих лимфоцитов периферической крови представляет собой морфологически зрелые малые лимфоциты (клетки памяти и наивные), которые осуществляют иммунологический надзор за гомеостазом.
Важным показателем активизации иммунной системы в ответ на вторжение чужеродных агентов является изменение морфологии лимфоидных клеток.
Распознавание лимфоцитами антигена и вступление их в защитную реакцию сопровождается реактивными изменениями клеток (активизация реакций метаболизма в клетке, синтез РНК и ДНК и другие процессы), что меняет морфологию лимфоидных клеток. При морфологической оценке можно различить покоящиеся, нестимулированные малые лимфоциты и активированные реактивные формы.
Они отличаются от покоящихся лимфоцитов выраженным полиморфизмом, который касается всех морфологических характеристик: размера и формы клетки; формы и структуры ядер; ширины, цвета и структуры цитоплазмы. В большинстве случаев это позволяет дифференцировать активированные (реактивные) лимфоциты и неактивные («спокойные») клетки (см. таблицу). Полиморфизм лимфоидных клеток при иммунных реакциях отражает разные стадии их стимуляции.
Реактивные лимфоциты в лейкоцитарной формуле
Реактивные лимфоциты в периферической крови являются признаком практически любой антигенной стимуляции в организме (вирусная инфекция, коклюш, токсоплазмоз, туберкулез, аутоиммунная патология и др.). Не существует специфических морфологических изменений лимфоцитов при конкретном заболевании, в т. ч. при ИМ. К сожалению, до сих пор в клинико-диагностических лабораториях пользуются терминами «широкоцитоплазменные лимфоциты», «атипичные мононуклеары», «иммунобласты», «лимфомоноциты» и др.
Необходимо помнить, что лимфоциты и у здорового человека могут быть относительно разнообразны по морфологии, т. к. в сосудистом русле циркулируют лимфоидные клетки разной степени активности. Иммунная система незаметно для нас постоянно работает: удаляет проникшие бактерии и вирусы, изменившиеся собственные клетки и молекулы.
При подсчете лейкоцитарной формулы здорового человека могут встречаться единичные крупные лимфоидные клетки — реактивные лимфоциты (0–4 %). При активизации лимфоидной системы (инфекции и др.) такие клетки поступают в периферическую кровь в большем количестве — 5–15 %. При этом в анализе крови отмечают присутствие реактивных лимфоцитов. В некоторых случаях при необходимости указывается процент таких клеток (более 15 %, клиническая картина характерна для ИМ).
Активированные лимфоидные клетки в значительном количестве (до 10–15 %) постоянно встречаются в лейкоцитарной формуле у детей раннего возраста в связи с формированием адаптивных специфических иммунных реакций (незаметная фоновая иммунизация антигенами окружающей среды).
Определение количества реактивных лимфоцитов наиболее важно при диагностике ИМ.
Реактивные лимфоциты и диагностика инфекционного мононуклеоза
Первые упоминания о заболевании «инфекционный мононуклеоз» в медицинской литературе появляются в начале 19-го века, когда и прозвучал термин «атипичные мононуклеары».
Примитивные методы приготовления и окраски мазков крови не позволяли четко различить лимфоидные клетки и моноциты. Суммарно их объединяли в группу «мононуклеары». Появление необычных, разнообразных по морфологии клеток — «атипичных мононуклеаров» — до сих пор является одним из важных диагностических критериев ИМ. Природу этих клеток и загадку появления в большом количестве ученые смогли разгадать лишь к концу 20-го века, но, по-видимому, еще не окончательно.
Однако уже более 50 лет назад четко доказали, что лимфоидные клетки в периферической крови пациентов с ИМ представляют собой активированные лимфоидные клетки, которые находятся на разных ступенях стимуляции. Поэтому термин «атипичные мононуклеары», используемый до настоящего времени в ряде учреждений при диагностике ИМ, явно и очень давно устарел. Абсолютное количество моноцитов при этом, как правило, сохраняется в нормальных пределах.
Количество реактивных лимфоцитов при ИМ может быть различным (от единичных клеток до 60–80 %), изредка они могут отсутствовать. В настоящее время ИМ не диагностируют на основании только обнаружения реактивных лимфоцитов.
Вместе с тем в большинстве случаев количество этих клеток бывает значительным, обычно больше, чем при аденовирусной инфекции, гриппе или других заболеваниях, протекающих с активизацией иммунного ответа. Объяснение этому было найдено относительно недавно. При ИМ возбудители (вирус Эпштейна — Барр и/или цитомегаловирус, реже другие герпес-вирусы) поражают наряду с эпителиальными клетками носоглотки множество клонов В-лимфоцитов, на поверхности которых имеются рецепторы к этим вирусам. В ответ на стимулированные и инфицированные В-лимфоциты появляются, как защитная реакция, стимулированные цитотоксические Т-лимфоциты, поэтому реактивных лимфоцитов в крови мы видим гораздо больше (более 15–20 %). По морфологии реактивные В- и Т-клетки различить невозможно.
Значительное количество реактивных лимфоцитов можно наблюдать на фоне типичной клинической картины ИМ: лихорадка, назофарингит, ангина, лимфаденопатия (увеличены главным образом лимфоузлы задней поверхности шеи, затылка), увеличение селезенки и зачастую печени. Диагностика основывается на особенностях клинической картины заболевания, обнаружении в крови более 15–20 % реактивных лимфоцитов, наличии антител к антигенам вируса Эпштейна — Барр и/или другим герпес-вирусам, высоком уровне гетерофильных антител, результате ПЦР.
Врач-клиницист ставит диагноз ИМ на основании анализа клинической картины, комплекса лабораторных исследований.
Вывод
Любая антигенная стимуляция иммунного ответа приводит к появлению в периферической крови реактивных лимфоцитов. Вместе с тем не существует специфических морфологических изменений реактивных лимфоидных клеток при отдельных заболеваниях, в т. ч. при ИМ.
Международным комитетом по лабораторной гематологии рекомендовано заменить устаревшее обозначение «атипичные мононуклеары» на термин «реактивные лимфоциты». Именно это понятие более точно отражает функциональное состояние клетки, нежели «широкоцитоплазменный лимфоцит» либо «атипичный мононуклеар». Избыточное разнообразие терминов для обозначения стимулированных лимфоцитов затрудняет интерпретацию клиницистами результатов исследования лейкоцитарной формулы.
Таблица. Сравнительная характеристика реактивного и нестимулированного лимфоцита.