(Окончание. Начало материала читайте здесь.)
Основы фармакотерапии хронической боли разрабатывались в соответствии с трехступенчатой лестницей обезболивания (см. рис. 2) согласно рекомендациям ВОЗ.
Рис. 2. Трехступенчатая лестница обезболива- ния ВОЗ (Cancer pain relief, 3nd ed. Geneva, WHO, 2018).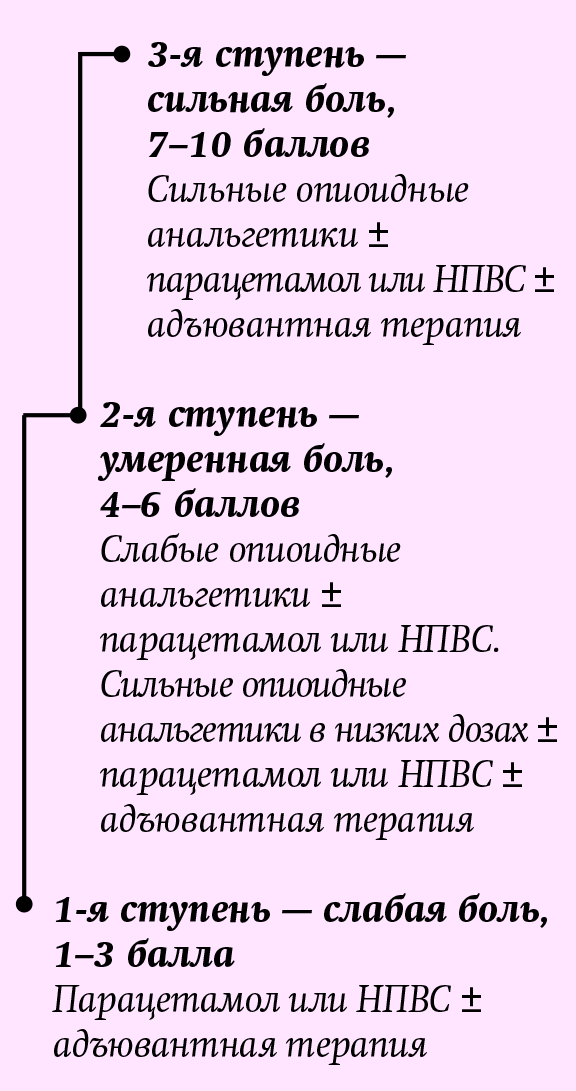 Принципы фармакотерапии хронического болевого синдрома:
Принципы фармакотерапии хронического болевого синдрома:
- дозу анальгетиков подбирают индивидуально в зависимости от интенсивности и характера боли, добиваясь ее устранения или облегчения в течение первых 48 часов от начала лечения;
- назначают анальгетики регулярно строго «по часам», а не «по требованию», т. е. очередную дозу лекарственного средства пациент должен получать до прекращения действия предыдущей дозы;
- анальгетики применяют по восходящей, т. е. от максимальной дозы слабо действующего препарата к минимальной дозе сильно действующего;
- терапия опиоидами является основным методом лечения боли, опиоидные анальгетики титруют до получения клинического эффекта;
- нежелательные реакции анальгетиков должны предупреждаться, а в случаях их возникновения адекватно лечиться;
- основными способами введения лекарственных средств являются неинвазивные — пероральный, ректальный и трансдермальный; по возможности следует избегать инъекционного введения анальгетиков;
- при лечении хронического болевого синдрома любой интенсивности прежде, чем увеличивать дозу анальгетика, необходимо назначить адъюванты.
Фармакотерапия слабой боли (1–3 балла по НОШ, 1-я ступень обезболивания)
Основными лекарственными средствами фармакотерапии слабой боли являются парацетамол и НПВС (см. табл. 4).
Таблица 4. НПВС в лечении хронического болевого синдрома.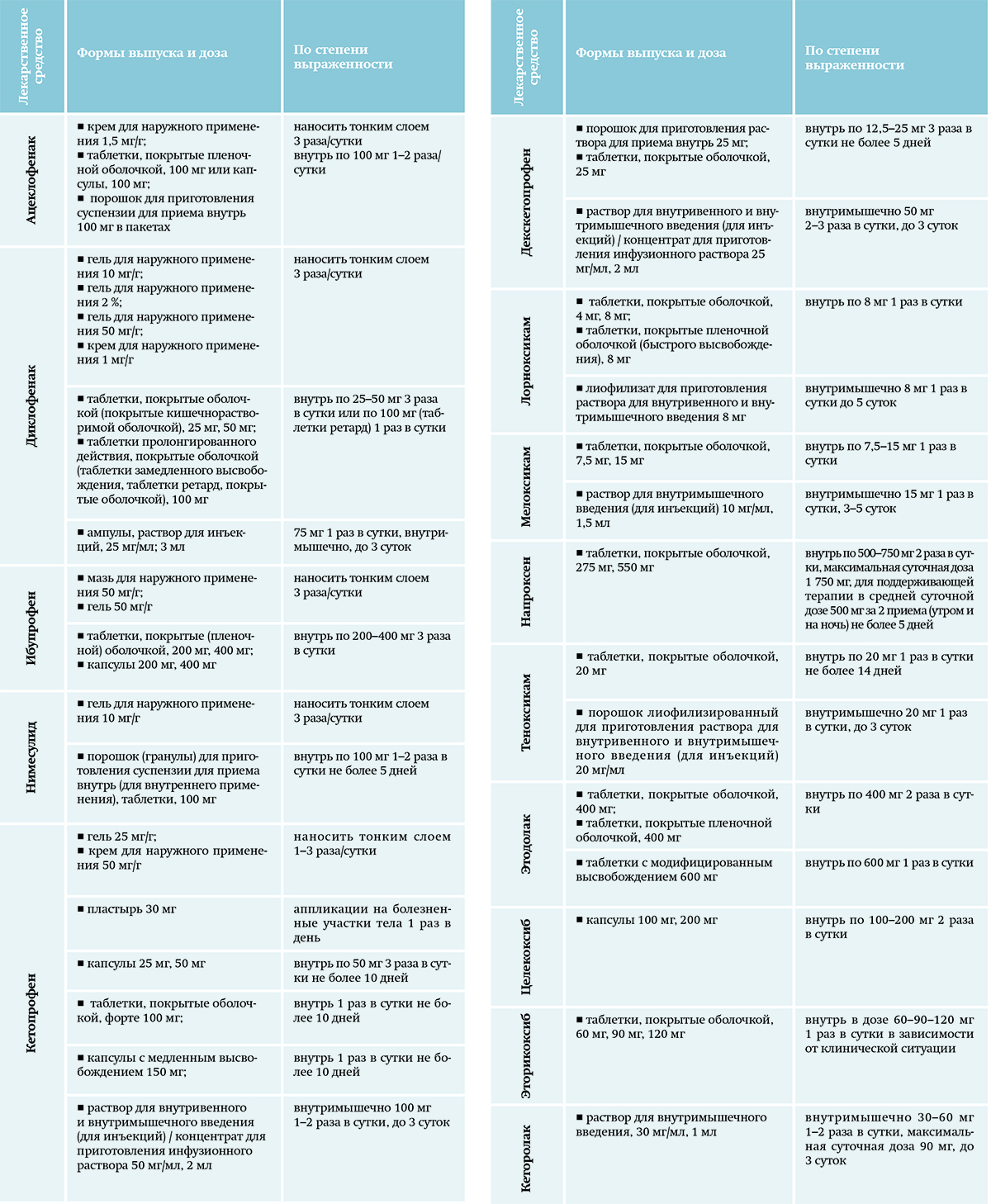 Парацетамол назначается по 500–1 000 мг внутрь каждые 6–8 ч длительно, максимальная суточная доза 3 000 мг. Нежелательные реакции дозозависимы.
Парацетамол назначается по 500–1 000 мг внутрь каждые 6–8 ч длительно, максимальная суточная доза 3 000 мг. Нежелательные реакции дозозависимы.
Выбор НПВС осуществляется эмпирически. Стратегия выбора конкретного лекарственного препарата для длительного применения включает оценку эффективности и безопасности лечения с учетом выраженности обезболивающего действия, избирательности относительно ЦОГ-1 и ЦОГ-2, наличия или отсутствия факторов риска со стороны ЖКТ, сердечно-сосудистой системы, почек, предпочтения пациента (для лиц, уже принимающих препараты в течение длительного времени).
Сравнительная характеристика НПВС по выраженности анальгетического действия (от самого сильного к слабому): лорноксикам, кетопрофен > кеторолак > диклофенак > индометацин > метамизол > пироксикам, теноксикам, мелоксикам > нимесулид > напроксен > ибупрофен > фенилбутазон > целекоксиб > аспирин > ацетаминофен.
Классификация НПВС в зависимости от избирательности относительно изомеров ЦОГ:
- селективные ингибиторы ЦОГ-1 — низкие дозы ацетилсалициловой кислоты (75–100 мг);
- классические НПВС — неселективные ингибиторы ЦОГ-1 и ЦОГ-2;
- селективные ингибиторы ЦОГ-2 — нимесулид, мелоксикам, этодолак, набуметон;
- высокоселективные (специфические) ингибиторы ЦОГ-2 (коксибы) — целекоксиб, рофекоксиб, вальдекоксиб, эторикоксиб, лумиракоксиб;
- селективные ингибиторы ЦОГ-3 (ацетаминофен, метамизол).
Факторы риска развития нежелательных лекарственных реакций со стороны ЖКТ:
- умеренный риск — пожилой возраст, язвенный анамнез (редкие рецидивы язв), прием глюкокортикостероидов (ГКС), курение и прием алкоголя, наличие хеликобактерной инфекции;
- высокий риск — язвенный анамнез, прием препаратов, влияющих на свертываемость крови;
- очень высокий риск — осложненные язвы (кровотечения, перфорации), часто рецидивирующие язвы, особенно НПВС-индуцированные, комбинация двух и более различных факторов риска.
Риск со стороны пищевода и кишечника: заболевания пищевода, ГЭРБ, заболевания тонкой и толстой кишки, хронические воспалительные заболевания кишечника, дивертикулы, клинически выраженное нарушение микробного равновесия.
Риск со стороны печени: заболевания печени, сопровождающиеся нарушением функции, хронический алкоголизм, сопутствующий прием гепатотоксических препаратов.
Факторы риска развития нежелательных лекарственных реакций со стороны сердечно-сосудистой системы:
- умеренный риск — компенсированные лечением АГ и ХСН, наличие традиционных кардиоваскулярных рисков при отсутствии ИБС;
- высокий риск — некомпенсированные АГ и ХСН, неосложненная ИБС;
- очень высокий риск — ИБС с перенесенным инфарктом миокарда, операции на сердце (АКШ, эндоваскулярное стентирование), ишемический инсульт.
Факторы риска развития нежелательных лекарственных реакций со стороны почек (НПВС-индуцированная нефропатия): заболевания почек, сопровождающиеся нарушением клубочковой фильтрации или протеинурией, заболевания печени, гиповолемия, существенное снижение АД.
Особенности применения НПВС:
- лекарственные формы НПВС для наружного применения рекомендуется назначать на срок не более 14 суток с последующим перерывом на несколько дней. Применяются у пациентов со слабым болевым синдромом или в комплексном лечении болевого синдрома у пациентов со значительным числом коморбидных заболеваний и состояний, ограничивающих применение НПВС внутрь или парентерально;
- лекарственные формы НПВС для парентерального применения используются коротким курсом 3–5 дней;
- при недостаточном анальгетическом эффекте лексредства первого выбора НПВС возможна замена на другое лексредство из этой же группы;
- назначать пациентам одновременно два и более НПВС нельзя. Допускается назначение комбинации парацетамола и НПВС;
- пролонгированные лекарственные формы НПВС могут использоваться после подбора эффективной суточной дозы препаратов короткого действия.
Метамизол, таблетки 500 мг, раствор для внутривенного и внутримышечного введения 500 мг/мл, 2 мл не используется в монотерапии слабой боли. Чаще применяется в составе комбинированных лекарственных форм анальгетиков для лечения или предупреждения прорывной боли. Таблетки 500 мг внутрь каждые 6 часов назначаются не более 5 дней подряд. Лицам пожилого возраста и пациентам с почечной или печеночной недостаточностью назначать с осторожностью.
При применении высоких доз НПВС, парацетамола, отсутствии целевого обезболивающего эффекта, нарастании риска развития нежелательных лекарственных реакций пациентам назначают лечение препаратами второй ступени обезболивания.
Фармакотерапия умеренной боли (4–6 баллов по НОШ, 2-я ступень обезболивания)
Основными лекарственными средствами фармакотерапии умеренной боли являются «слабый» опиоид трамадол и «сильные» опиоиды в низких дозах: тапентадол, оксикодон + налоксон, морфин, гидроморфон, фентанил (см. табл. 5).
Таблица 5. Вторая ступень обезболивания. Трамадол в зависимости от характера и интенсивности боли назначается через каждые 8 или 6 часов, разовая доза 50–100 мг. Разовую дозу следует увеличивать, учитывая ритм боли. При персистирующей боли без четкого ритма следует увеличить разовую дозу, принимаемую перед сном («хорошая ночь — хороший день»). В исключительных случаях у пациентов с хорошей переносимостью трамадола возможно сокращение интервала приема до 4 часов и увеличение суточной дозы до 600 мг.
Трамадол в зависимости от характера и интенсивности боли назначается через каждые 8 или 6 часов, разовая доза 50–100 мг. Разовую дозу следует увеличивать, учитывая ритм боли. При персистирующей боли без четкого ритма следует увеличить разовую дозу, принимаемую перед сном («хорошая ночь — хороший день»). В исключительных случаях у пациентов с хорошей переносимостью трамадола возможно сокращение интервала приема до 4 часов и увеличение суточной дозы до 600 мг.
Если при применении трамадола побочные эффекты равны или превалируют над анальгетическим действием, не поддаются коррекции в течение 3–5 дней, следует перевести пациента на пероральный морфин или другой «сильный» опиоид в эквианальгетической дозе (эквианальгетическая (эквивалентная) доза — это доза наркотического лекарственного средства, вызывающая анальгезию, соответствующую по эффекту дозе перорального морфина) (см. табл. 6).
Таблица 6. Пересчет эквианальгетических доз наркотических лексредств.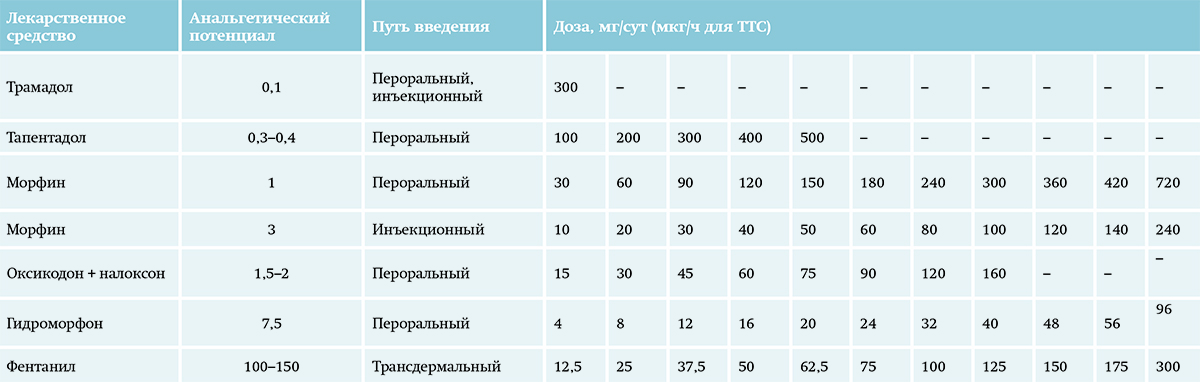
Анальгетический потенциал рассчитан по отношению к пероральному морфину, анальгетический эффект которого принят за 1. Для определения эквипотенциальной дозы перорального морфина умножьте дозу опиоида из 1-й колонки на анальгетический потенциал, для определения эквипотенциальной дозы опиоида из 1-й колонки нужно разделить дозу перорального морфина на анальгетический потенциал. В целях безопасного перехода с одного опиоидного анальгетика на другой необходимо расчетную эквипотенциальную дозу нового препарата при первом применении снизить на 30–50 %, а затем, при отсутствии выраженных нежелательных эффектов, постепенно повышать ее до необходимой.
Морфин принимается за эталон при расчете эквианальгетических доз. При лечении боли 2-й ступени суточная доза морфина не превышает 30 мг при пероральном приеме, или 10 мг в сутки при парентеральном введении, или назначается другой «сильный» опиоид в эквивалентной дозе.
Для опиоид-наивных пациентов (опиоид-наивный пациент — это пациент, никогда не получавший опиоидную терапию либо принимающий менее 60 мг перорального морфина в сутки не более 2 недель или эквианальгетическую дозу другого опиоидного анальгетика) начальная разовая доза составляет 2,5 мг перорального морфина короткого действия с последующим подбором эффективной суточной дозы. В стандартной ситуации морфин назначается перорально каждые4 часа (максимально до 30 мг в сутки). В стационарных условиях возможно парентеральное введение 1 мл 1 % раствора морфина (10 мг) в 20–50 мл 0,9 % раствора хлорида натрия с использованием шприцевого дозатора или инфузомата методом продленной 24-часовой инфузии подкожно или внутривенно.
Если в течение 2–3 дней подобранная суточная доза адекватно контролирует боль, можно перевести пациента на пролонгированные формы морфина или на другие опиоиды в эквивалентной дозе, подобрав нужную разовую дозировку препарата с учетом кратности его введения.
Тапентадол — препарат выбора при лечении умеренной и сильной боли с выраженным нейропатическим компонентом.
Оксикодон + налоксон — препарат выбора при лечении умеренной и сильной боли у пациентов с выраженными нарушениями моторики кишечника, так как позволяет снизить риск развития опиоид-индуцированного запора.
Гидроморфон — доза препарата 4 мг предназначена для подбора суточной дозы в начале лечения с учетом индивидуальной чувствительности пациента.
Фентанил — для терапии умеренной боли рекомендуется использовать в дозе 12,5 мкг/ч. Пластырь действует в течение 72 часов и является предпочтительным для пациентов с умеренной и тяжелой степенью почечной и печеночной недостаточности.
Для обеспечения адекватного контроля боли и побочных эффектов лечения, замедления развития опиоидной толерантности назначение опиоидных анальгетиков осуществляется в комбинации с неопиоидными анальгетиками и адъювантами.
При лечении опиоидами следует тщательно и регулярно контролировать состояние пациента, своевременно диагностировать и устранять побочные эффекты фармакотерапии (тошнота, рвота, анорексия, задержка мочи, запор, головокружение, серотониновая токсичность у пожилых людей), а также оценивать оправданность дальнейшего приема препарата.
Анальгетический потенциал рассчитан по отношению к пероральному морфину, анальгетический эффект которого принят за 1.
Для определения эквипотенциальной дозы перорального морфина умножьте дозу опиоида из 1-й колонки на анальгетический потенциал, для определения эквипотенциальной дозы опиоида из 1-й колонки нужно разделить дозу перорального морфина на анальгетический потенциал. В целях безопасного перехода с одного опиоидного анальгетика на другой необходимо расчетную эквипотенциальную дозу нового препарата при первом применении снизить на 30–50 %, а затем, при отсутствии выраженных нежелательных эффектов, постепенно повышать ее до необходимой.
Фармакотерапия сильной боли (7–10 баллов по НОШ, 3-я ступень обезболивания)
Для фармакотерапии сильной боли используют «сильные» опиоиды. Для подбора суточной дозы, обеспечивающей анальгетический эффект, используют, как правило, метод титрования короткодействующими опиоидами.
Морфин короткого действия назначают в разовой дозе 5–10 мг в форме таблеток и/или растворов для перорального приема 4 раза в сутки.
Максимальную эффективность назначенной дозы перорального морфина следует оценить через 60–90 минут после приема. Если эффект неудовлетворителен (боль сохраняется), то следует назначить дополнительную (дотационную) дозу морфина, не изменяя плановое время приема следующей дозы.
Для пожилых, ослабленных, пациентов с кахексией терапию пероральным морфином начинают с разовой дозы 2,5–5 мг (суточная 10–20 мг).
Через 24 часа необходимо определить принятую за предыдущие сутки суммарную дозу и назначить пациенту схему терапии «по часам». Итоговую эффективную суточную дозу морфина оценивают путем простого суммирования всех примененных за сутки доз. Если в течение 3 дней подобранная суточная доза адекватно контролирует боль, можно перевести пациента на пролонгированные формы морфина или на другие опиоиды в эквивалентной дозе, подобрав нужную разовую дозировку препарата с учетом кратности его введения.
Если доза морфина короткого действия недостаточна, следует продолжить ее постепенное повышение каждый раз не более чем на 30–50 % от суточной дозы, до достижения полноценного контроля боли или появления трудно контролируемых нежелательных реакций. В последнем случае следует рассмотреть вопрос об изменении лечения (отмене морфина и использовании другого опиоида либо уменьшении дозы морфина и добавлении других препаратов, использование нефармакологических методов и т. д.).
«Сильные» опиоиды, применяемые на 3-й ступени, как правило, не имеют потолка суточной дозы. Максимальные доза опиоидного анальгетика лимитируется исключительно нежелательными реакциями препарата и индивидуальной непереносимостью.
В зависимости от клинической ситуации (например, стабильный болевой синдром), возможно сразу назначить пролонгированные лекарственные формы наркотических анальгетиков:
- морфин, таблетки пролонгированного действия 10 мг, 30 мг, 60 мг, 100 мг 12-часового действия, назначаются внутрь после подбора суточной дозы 2 раза в сутки, стартовая доза 30 мг внутрь 2 раза в сутки (суточная доза 60 мг);
- гидроморфон, назначается внутрь после подбора суточной дозы 1 раз в сутки, стартовая разовая доза 8 мг;
- фентанил, ТТС, назначается при стабильном выраженном болевом синдроме, стартовая доза 25 мкг/ч на 72 часа. Анальгезирующий эффект реализуется через 12–18 часов и достигает пика, как правило, в период между 24 и 48 часами, продолжаясь до 72 часов. Если после первого применения адекватное обезболивание не достигнуто, то последующая доза может быть увеличена только после окончания действия предыдущей ТТС, т. е. не ранее чем через 72 часа после размещения на теле. Если требуется, то дозу увеличивают каждые 3 дня на 12,5–25 мкг/ч. При дозе, превышающей максимальную дозировку имеющегося в наличии фентанила в виде ТТС, одновременно наклеивают несколько систем в соответствующей суммарной дозировке. Фентанил в виде ТТС не рекомендуется применять у пациентов с кахексией, выраженной лимфедемой, внутричерепной гипертензией, противопоказан пациентам с гипергидрозом, гипертермией.
Пациентам, которые не могут глотать, подбор дозы опиоида осуществляется парентеральным введением раствора морфина в дозах 2,5–5 мг каждые 6 часов подкожно. В стационарных условиях осуществляется титрование дозы методом продленной 24-часовой инфузии подкожно или внутривенно 20 мг морфина в 20–50 мл 0,9 % раствора хлорида натрия с использованием шприцевого дозатора или инфузомата. Стартовая доза для пожилых, ослабленных, пациентов с кахексией составляет 10 мг в течение 24 часов.
Тапентадол, стартовая доза по 100 мг внутрь 2 раза в сутки. Для титрования можно использовать его лекарственную форму с немедленным высвобождением — таблетки, покрытые пленочной оболочкой, по 50 мг каждые 4–6 часов, причем при отсутствии эффекта вторая доза препарата может быть принята через 1 ч после приема начальной дозы. Максимальная суточная доза 500 мг.
Оксикодон + налоксон, стартовая суточная доза 20 мг/10 мг внутрь 1–2 раза в сутки, максимальная суточная доза 160 мг/80 мг.
Смена (ротация) опиоидного анальгетика. Замена опиоидного анальгетика и/или способа его введения показана при недостаточном обезболивающем эффекте препарата и/или при развитии непереносимых нежелательных реакций. При ротации опиоидного анальгетика следует использовать начальную дозировку нового препарата на 25–50 % ниже, чем рассчитанную по таблице эквианальгетических доз.
Терапия прорывной боли
Для предупреждения эпизодов предсказуемой прорывной боли опиоид короткого действия принимается за 30–40 минут до известного провоцирующего воздействия, а также для купирования эпизода прорывной боли с медленным началом развития.
Доза опиоидного анальгетика для предупреждения/купирования прорывной боли составляет 1/6 (10–15 %) получаемой суточной дозы опиоида.
Если в течение суток пациенту требуется 4 и более дозы опиоида для купирования прорывной боли, необходимо пересмотреть суточную дозу принимаемого опиоида в сторону ее увеличения.
Адъювантные лекарственные средства
Адъюванты — лекарственные средства, которые не оказывают непосредственного обезболивающего действия, однако способствуют уменьшению боли и обладают морфин-сберегающим эффектом (см. табл. 7). Основной целью применения их является облегчение боли, которую не удалось устранить с помощью монотерапии анальгетиками и/или уменьшение нежелательных реакций ее лечения (например, уменьшить дозу опиоидов).
Таблица 7. Адъювантные лекарственные средства.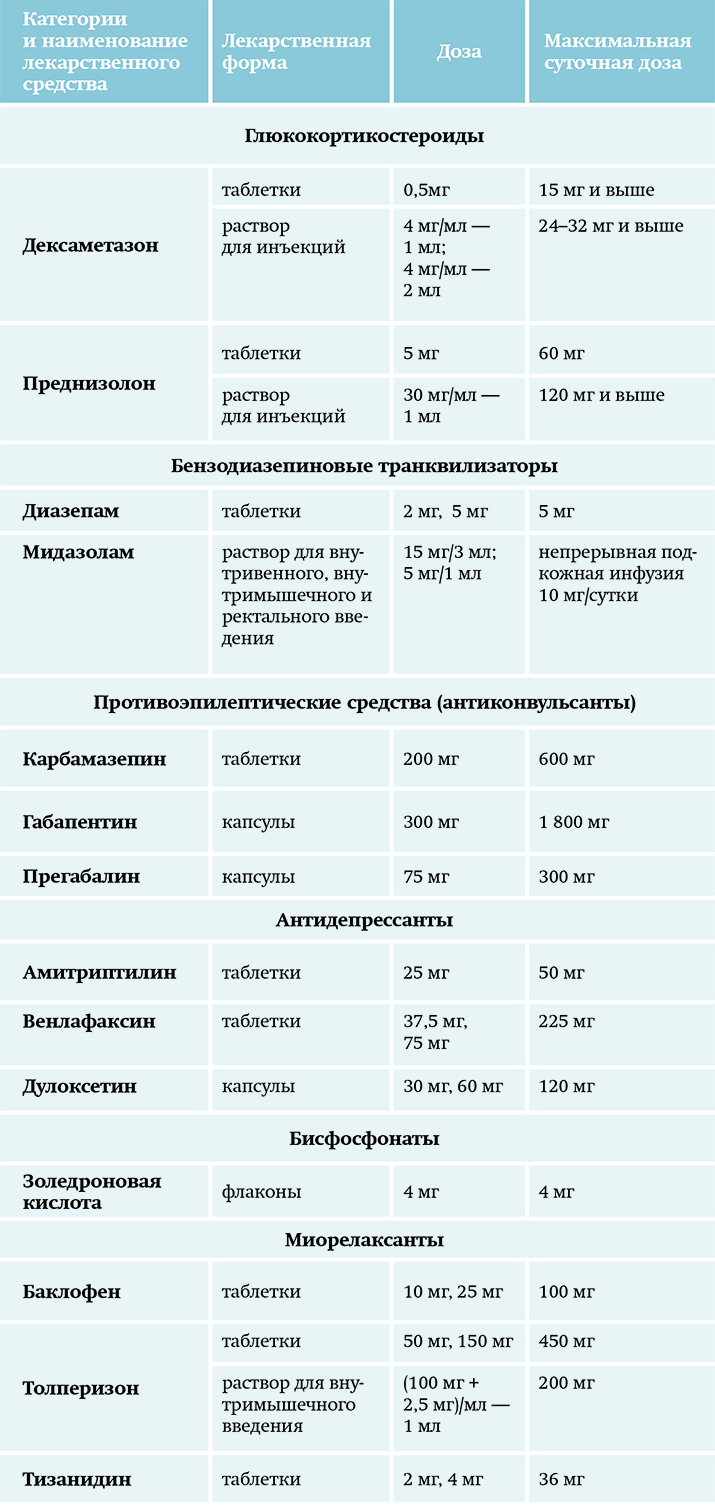 Адъюванты могут быть лексредствами первой линии фармакотерапии при нейропатической боли. Назначаются индивидуально в зависимости от конкретной клинической ситуации.
Адъюванты могут быть лексредствами первой линии фармакотерапии при нейропатической боли. Назначаются индивидуально в зависимости от конкретной клинической ситуации.
Если болевой синдром обусловлен поражением костей вследствие первичного или вторичного опухолевого процесса, следует назначать бисфосфонаты:
- золедроновая кислота, порошок лиофилизированный для приготовления раствора для инфузий 4 мг во флаконах, концентрат для приготовления раствора для инфузий 4 мг/5 мл во флаконах, внутривенно капельно, разовая доза 4 мг, максимальная суточная доза 4 мг;
- повторное введение, как правило, через 4 недели, длительность курса зависит от конкретной клинической ситуации. Раствор для инфузии готовят в асептических условиях, 4 мг порошка растворяют в 5 мл воды для инъекций, полученный раствор разводят в 100 мл 0,9 % раствора хлорида натрия или 5 % глюкозы, концентрат также разводят в 100 мл 0,9 % раствора хлорида натрия или 5 % глюкозы, длительность внутривенной инфузии не менее 15 минут.
При спазмах скелетных мышц назначают миорелаксанты центрального действия и бензодиазепины:
- баклофен, таблетки 10 мг, таблетки 25 мг, стартовая доза 5 мг 3 раза в сутки, через 3 дня приема разовая доза увеличивается вдвое, в последующие 3 дня разовая доза увеличивается до 15 мг, в течение следующих 3 дней до 20 мг, в случае клинической необходимости суточная доза может быть с осторожностью увеличена до 100 мг; пациенты, получающие в сутки дозу более 60 мг, должны находиться в стационаре под постоянным медицинским наблюдением;
- тизанидин, таблетки 2 мг, 4 мг, назначают по 2–4 мг 3 раза в сутки, начальная суточная доза не должна превышать 6 мг, разовая доза повышается постепенно на 2–4 мг интервалами 3–7 дней, кратность может быть увеличена до 4 раз в сутки, максимальная суточная доза не должна превышать 36 мг;
- толперизон, таблетки, покрытые пленочной оболочкой, 50 мг и 150 мг, раствор для внутримышечного введения (100 мг + 2,5 мг)/мл —1 мл в ампулах, раствор назначают в разовой дозе (100 мг + 2,5 мг)/мл — 1 мл 2 раза в сутки, максимальная суточная доза 200 мг, таблетки назначают в разовой дозе 50–150 мг 3 раза в сутки, максимальная суточная доза 450 мг;
- диазепам, таблетки 2 мг и 5 мг, перорально 2–5 мг на ночь, краткосрочная терапия;
- мидазолам, ампулы, раствор для внутривенного, внутримышечного и ректального введения 15 мг/3 мл; раствор для внутривенного, внутримышечного и ректального введения 5 мг/1 мл в ампулах, назначают в последние дни жизни в виде непрерывной подкожной инфузии 10 мг/сутки, предварительно растворив 10 мг в 20 мл 0,9 % раствора хлорида натрия.
При спазмах гладкой мускулатуры назначают спазмолитики:
- гиосцина бутилбромид, ампулы, раствор для инъекций 20 мг/мл — 1 мл, таблетки, покрытые оболочкой,
- 10 мг, суппозитории ректальные 10 мг, разовая доза 10–20 мг, максимальная суточная доза 100 мг;
- папаверин, ампулы, раствор для инъекций 20 мг/мл — 2 мл, подкожно или внутримышечно по 10–40 мг, максимальная разовая доза 100 мг, максимальная суточная 300 мг, при внутривенном введении разовая доза 20 мг, максимальная суточная доза 120 мг, внутривенно вводить медленно со скоростью 3–5 мл/мин, предварительно растворив 10–20 мг в 20 мл 0,9 % раствора хлорида натрия;
- дротаверин, ампулы, раствор для инъекций 20 мг/мл — 2 мл, таблетки 40 мг и 80 мг, разовая доза 40–80 мг перорально или внутримышечно 1–3 раза в сутки, максимальная суточная доза 240 мг.
Для уменьшения периферической сенситизации назначают препараты из группы НПВС и ГКС, доза которых подбирается индивидуально в зависимости от показаний и тяжести состояния:
- дексаметазон, таблетки 0,5 мг, ампулы, раствор для инъекций 4 мг/мл — 1 мл, раствор для инъекций 4 мг/мл — 2 мл в ампулах, перорально суточная доза 2–6 мг, по специальным показаниям до 15 мг и выше, внутримышечно разовая доза 4–8 мг, суточная доза 8–16 мг, по специальным показаниям суточная доза может быть увеличена до 24–32 мг и выше;
- преднизолон, таблетки 5 мг, раствор для инъекций 30 мг/мл — 1 мл в ампулах, перорально суточная доза 5–60 мг, внутримышечно разовая доза 30–45 мг, суточная доза 30–120 мг и выше.
При наличии эктопических очагов возбуждения, вызванных повреждением нервной ткани и центральной сенситизации, назначают антиконвульсанты; для активации антиноцицептивной системы — антидепрессанты.
Немедикаментозные методы лечения ХБ
В комплексном лечении ХБ наряду с фармакотерапией достаточно широко применяются различные немедикаментозные методы:
- психотерапия;
- физиотерапевтические методы (ультразвук, коротковолновая диатермия, криотерапия, электротерапия, чрескожная электронейростимуляция, акупунктура, массаж (ручной, вибрационный), ароматерапия, лечебная физкультура);
- интервенционные методы (блокады различных нервов и нервных сплетений, эпидуральная анестезия, центральная электронейростимуляция, консервативная и хирургическая денервация).
Заключение. В связи с разнообразием механизмов возникновения боли лечение каждого пациента должно быть индивидуализировано с учетом основного заболевания, явившегося причиной боли, клинических особенностей болевого синдрома и фармакологических характеристик лексредств. При этом обязательно участие различных специалистов — терапевтов, неврологов, ревматологов, психотерапевтов, физиотерапевтов — для реализации комплексного междисциплинарного подхода в решении важнейшей задачи избавления пациентов от страданий.
